
分析 (1)根据n=$\frac{m}{M}$计算NaCl的物质的量,溶液中n(Cl-)=n(NaCl),根据c=$\frac{n}{V}$计算NaCl、Cl-的物质的量浓度;
(2)根据电荷守恒:c(H+)+c(Na+)=c(Cl-),据此计算c(H+);根据n=cV计算溶液中H+的物质的量,而氢离子源于HCl的电离,故n(HCl)=n(H+),再根据V=nVm计算HCl的体积.
解答 解:(1)117g NaCl的物质的量=$\frac{117g}{58.5g/mol}$=2mol,溶于水配成1L溶液,故c(NaCl)=$\frac{2mol}{1L}$=2mol/L,溶液中n(Cl-)=n(NaCl)=2mol,故c(Cl-)=$\frac{2mol}{1L}$=2mol/L,
故答案为:2mol/L;2mol/L;
(2)根据电荷守恒:c(H+)+c(Na+)=c(Cl-),故c(H+)=3mol/L-2mol/L=1mol/L,而氢离子源于HCl的电离,故n(HCl)=n(H+)=1L×1mol/L=1mol,故V(HCl)=1mol×22.4L/mol=22.4L,
故答案为:1mol/L;22.4L.
点评 本题考查物质的量浓度计算,难度不大,注意对公式的理解与灵活应用,(2)注意电解质混合溶液中离子浓度计算常用电荷守恒解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液中加入钠的小颗粒 | |
| B. | 饱和的Ca(OH)2溶液中加入钠的小颗粒 | |
| C. | NaOH的饱和溶液中加入钠的小颗粒 | |
| D. | 稀硫酸中加入钠的小颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
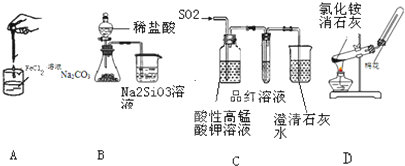
| A. | 制备氢氧化亚铁 | B. | 验证非金属性Cl>C>Si | ||
| C. | 检验二氧化硫中是否混有二氧化碳 | D. | 实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O═HClO+HSO3- | |
| C. | 向MgSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
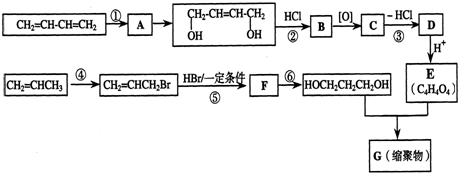
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com