
分析 (1)硝酸有剩余,Fe元素被氧化为Fe(NO3)3,计算生成混合气体总物质的量,结合电子注意守恒列方程计算NO2和NO各自物质的量,进而计算NO2的体积;
(2)反应N元素存在于Fe(NO3)3、NO2、NO及剩余的HNO3中,根据N原子守恒计算原浓硝酸中HNO3的物质的量,进而计算原浓硝酸的物质的量浓度;
(3)根据电子转移守恒计算需要过氧化氢的物质的量,进而计算需要30%双氧水的质量.
解答 解:(1)硝酸有剩余,Fe元素被氧化为Fe(NO3)3,反应生成的NO2和NO总物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,消耗Fe的物质的量为$\frac{16.8g}{56g/mol}$=0.3mol,
令NO2、NO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.5}\\{x+3y=0.3×3}\end{array}\right.$
解得x=0.3、y=0.2,
NO2的体积=0.2mol×22.4L/mol=4.48L,
故答案为:4.48L;
(2)反应N元素存在于Fe(NO3)3、NO2、NO及剩余的HNO3中,由Fe元素守恒生成Fe(NO3)3为0.3mol,剩余HNO3物质的量为0.16L×1mol/L=0.16mol,
根据N原子守恒,原浓硝酸中HNO3的物质的量=0.3mol×3+0.5mol+0.16mol=1.56mol,则原浓硝酸的物质的量浓度为$\frac{1.56mol}{0.16L}$=9.75mol/L,
故答案为:9.75;
(3)转移电子为0.3mol×3=0.9mol,根据电子转移守恒,需要过氧化氢的物质的量为$\frac{0.9mol}{2}$=0.45mol,需要30%双氧水的质量为$\frac{0.45mol×34g/mol}{30%}$=51g,
故答案为:51.
点评 本题考查混合物计算、氧化还原反应计算,侧重考查学生分析计算能力,注意原子守恒与电子转移守恒的应用.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O.lmol过氧化钠中,阴阳离子总数为0.4 NA | |
| B. | 11.2L氯气通入足量的NaOH充分反应,转移的电子数目为0.5 NA | |
| C. | 17g NH3气体含σ键的数目为3NA | |
| D. | 1L O.lmol/L氨水中,OH-数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
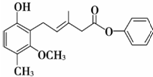
| A. | 该化合物既可以催化加氢,又可以在光照下与Cl2发生取代反应 | |
| B. | 该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色 | |
| C. | 该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2 | |
| D. | 1 mol该化合物最多可以与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过干馏等物理变化可以转化为清洁燃料 | |
| C. | 煎炸食物的花生油和牛油都属于酯类,属于高分子化合物 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
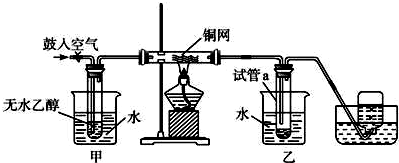
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
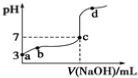
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
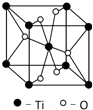 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com