
(1)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成化学方程式:CO2+4H2![]() _________+2H2O。
_________+2H2O。
(2)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)已知在443 K—473 K时,用钴(Co)作催化剂可使CO2和H2生成C5—C8的烷烃,这是人工合成汽油的方法之一。要达到该汽油的要求,CO2和H2的体积比的取值范围是V(H2):V(CO2):_________________________________________________________________。
(4)已知在一定条件下,合成尿素的反应为:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);ΔH=-127 kJ/mol,在该条件下,将44 g CO2与40 g NH3充分混合,反应放出的热量一定___________(填“大于”“小于”或“等于”)127 kJ。请设计工业合成尿素的条件___________。
CO(NH2)2(s)+H2O(g);ΔH=-127 kJ/mol,在该条件下,将44 g CO2与40 g NH3充分混合,反应放出的热量一定___________(填“大于”“小于”或“等于”)127 kJ。请设计工业合成尿素的条件___________。
解析:(1)由原子守恒可得出生成的另一物质为CH4:
(2)当CO2和H2以1∶3的比例混合,且产物中有水生成,可得反应方程式CO2+3H2![]() _________+_________H2O,再由氧原子守恒,则H2O的系数为2,最后得出生成的化工原料为CH2,当按照1∶3的比例调节CO2和H2的物质的量时,便可得到乙稀、丙稀、丁稀等一系列的烯烃,所以选B。
_________+_________H2O,再由氧原子守恒,则H2O的系数为2,最后得出生成的化工原料为CH2,当按照1∶3的比例调节CO2和H2的物质的量时,便可得到乙稀、丙稀、丁稀等一系列的烯烃,所以选B。
(3)运用极端假设法:
当生成5个碳的烷烃时,即C5H12,可得反应5CO2+16H2![]() C5H12+10H2O,此时V(H2):V(CO2)=16/5,取值最大;
C5H12+10H2O,此时V(H2):V(CO2)=16/5,取值最大;
当生成8个碳的烷烃时,即C8H18,可得反应8CO2+25H2![]() C8H18+16H2O,此时V(H2):
C8H18+16H2O,此时V(H2):
V(CO2)=25/8,取值最小。
所以25/8≤V(H2):V(CO2)≤16/5。
(4)理论上44 g CO2与34 g NH3恰好完全反应,而实际有44 g CO2与40 g NH3,NH3过量,但此反应为可逆反应,无论如何都不能完全转化,所以应小于127 kJ。再联想合成氨工业,结合CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)的特点,运用勒沙特列原理得出工业合成尿素的条件为:适当温度、高压、催化剂。
CO(NH2)2(s)+H2O(g)的特点,运用勒沙特列原理得出工业合成尿素的条件为:适当温度、高压、催化剂。
答案:(1)CH4 (2)B (3)25/8≤V(H2):V(CO2)≤16/5 (4)小于 适当温度、高压、催化剂


科目:高中化学 来源: 题型:
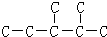 ,此烷烃的一溴代物有
,此烷烃的一溴代物有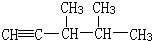
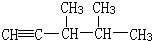
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
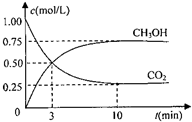
查看答案和解析>>
科目:高中化学 来源: 题型:
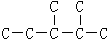 ,此烷烃的一溴代物有
,此烷烃的一溴代物有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com