
分析 (1)Fe元素为26号元素,原子核外有26个电子;
(2)Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能Na<Al<Mg;
(3)根据CO2分子的结构简式分析,双键中含有1个σ键、1个π键,单键属于σ键;
(4)丙烯中存在C=C-C,双键C中σ键为3,单键C的σ键为4,均不含孤对电子;
(5)根据等电子体中原子数相同、价电子数相同分析;
(6)根据价层电子对互斥理论确定空间构型.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能Na<Al<Mg,故答案为:Na<Al<Mg;
(3)CO2分子结构式为:O=C=O,双键中含有1个σ键、1个π键,单键属于σ键,故CO2分子中σ键与π键数目之比为1:1,故答案为:1:1;
(4)丙烯中存在C=C-C,双键C中σ键为3,单键C的σ键为4,均不含孤对电子,杂化类型分别为sp2、sp3,故答案为:sp2;sp3;
(5)CO含有2个原子14个电子,所以CO互为等电子体的一种分子的化学式为:N2,故答案为:N2;
(6)NH3的N原子价层电子对=$\frac{5+3}{2}$=4,且有一对孤电子对,所以是三角锥形结构,故答案为:NH3的N原子价层电子对=$\frac{5+3}{2}$=4,且有一对孤电子对,所以是三角锥形结构.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、等电子体的计算等知识点,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 跟金属钠反应 | |
| B. | 在足量氧气中完全燃烧生成CO2和H2O | |
| C. | 在浓硫酸存在时和乙酸发生酯化反应,生成乙酸乙酯和水 | |
| D. | 当银或铜存在时跟O2发生反应,生成乙醛和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
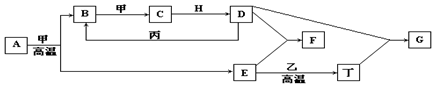
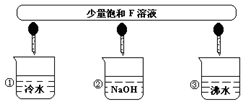
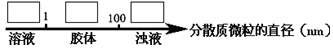
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m{N}_{A}}{18n}$ | B. | $\frac{18m{N}_{A}}{n}$ | C. | 18mnNA | D. | $\frac{n{N}_{A}}{18n}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com