
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有 |
| ②往①试管内的溶液中滴加 | 生成物有氢氧化钠 |
| 实验操作 | 实验现象 | 实验结论 |
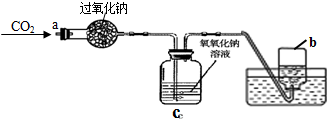
| ①将CO2从a口处通入装置内,充分反应后,再把带火星的木条放入收集满气体的集气瓶b中 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生;石灰水变浑浊 |
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 淡黄色粉末全部溶解,并有大量气泡产生 | ||
| 探究 | 氧气 | ||
| 无色酚酞试液 | 酚酞变红 |


科目:高中化学 来源: 题型:

| 仪器代号 | 所装试剂 | 装置作用 |
| A | 石灰石和 | 制取CO2证明硝酸比碳酸强 |
| C | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
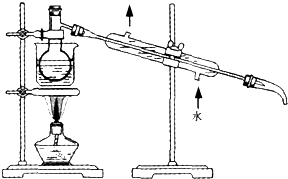
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 铵盐质量 | 10.00g | 20.00g | 30.00g | 40.00g |
| 浓硫酸增加的质量 | a g | a g | 0.68g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
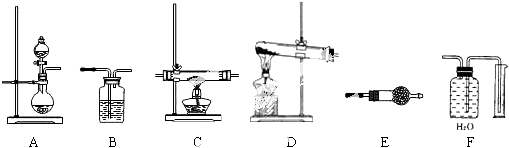
查看答案和解析>>
科目:高中化学 来源: 题型:
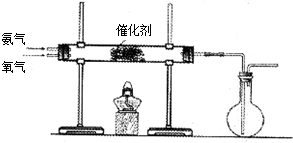
查看答案和解析>>
科目:高中化学 来源: 题型:
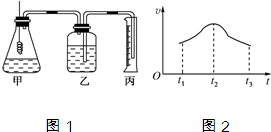
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com