
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的
△H=+2×283.0kJ/mol
C.△H>0,△S>0,在任何温度下都不可自发进行。
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值 ,下列说法正确的是( )
,下列说法正确的是( )
A.常温常压下,16 g O3气体含有氧原子数为NA
B.标准状况下,44.8 L四氯化碳含有的分子数为2NA
C.0.1 mol·L-1氯化铝溶液中含有Al3+数为0.1NA
D.2.4 g金属镁变为镁离子时失去的电子数为0. 1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在T ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知T ℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
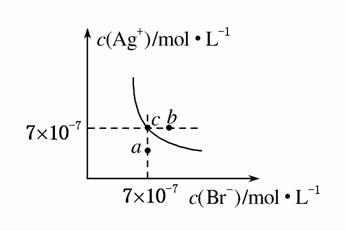
A.在T ℃时,AgBr的Ksp为4.9×10-13
B.图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液
C.图中a点对应的是AgBr的不饱和溶液
D.AgCl沉淀能较容易转化为AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符的是 ( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O
B.某溶液中存在大量Fe3+、S2ˉ、Clˉ、Na+,加入NaOH溶液发生反应:Fe3++3OHˉ=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na: Na+Al3++2H2O=Na++AlO2-+2H2↑
D.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
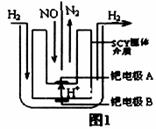 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)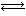 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A.2NO+O2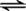 2NO2 B.N2O4
2NO2 B.N2O4 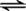 2NO2
2NO2
C.Br2(g)+H2 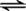 2HBr D.6NO+4NH3
2HBr D.6NO+4NH3 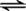 5N2+3H2O
5N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
A.①③④ B.①③⑤ C.②④⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO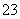 、NO
、NO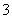 、SO
、SO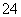 、SiO
、SiO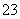 。现进行如下实验:
。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉 淀生成。
淀生成。
Ⅳ.向Ⅱ中所 得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为14,其离子方程式为Al+NO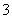 +OH-―→AlO
+OH-―→AlO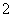 +NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO
+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO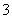 ,要消耗铝________g。
,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com