
| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
分析 A.化石燃料的燃烧能够产生大量微小尘粒、烟粒或盐粒等颗粒悬浮物;
B.海南存在雾霾天气,只不过较少;
C.雾霾能形成气溶胶,胶体具有丁达尔效应;
D.清洁能源的使用能够减少化石燃料的燃烧,减少烟尘等颗粒物排放;
解答 解:A.化石燃料的燃烧能够产生大量微小尘粒、烟粒或盐粒等颗粒悬浮物而形成雾霾,故A正确;
B.海南存在雾霾天气,只不过较少,仍然需要防治PM2.5的污染,故B错误;
C.雾霾能形成气溶胶,胶体具有丁达尔效应,所以在雾霾天气中行车,打开车灯可观察到丁达尔效应,故C正确;
D.调整工业能源结构,推广清洁能源的使用,能够减少化石燃料的燃烧,减少烟尘等颗粒物排放,能有效地减少PM2.5的污染,故D正确;
故选:B.
点评 本题考查了环境污染与治理,侧重考查pM2.5及雾霾的考查,明确污染源及治理方法是解题关键,有利于培养学生环境保护的意识,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将造纸废水通过高压水井压到地下或溶洞中,可减少污染 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
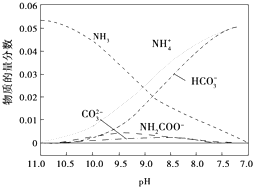
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 | |
| D. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
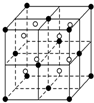 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
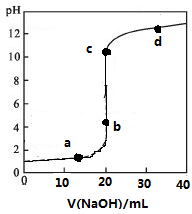 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
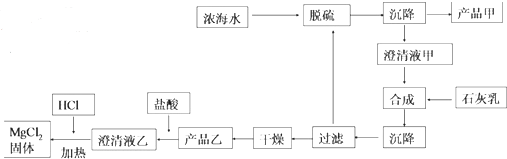
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
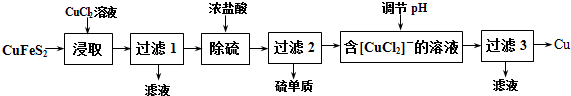
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com