


分析 (1)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物;
(2)根据化合价的升降判断被氧化的元素、氧化剂;
(3)根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数.
解答 解:(1)该反应中NO是生成物,则HNO3是反应物,N元素由反应物到生成物,化合价降低,所以HNO3是氧化剂;CuS中S元素的化合价是-2价,S中S元素的化合价是0价,要选取还原剂,只能是化合价由低变高,所以CuS作还原剂,S是氧化产物;再根据元素守恒,生成物中还有Cu(NO3)2,该反应中,HNO3是氧化剂,CuS作还原剂;HNO3→NO,N元素由+5价→+2价,一个HNO3得去3个电子;CuS→S,S元素由-2价→0价,生成一个S,需失2个电子,所以其得失电子的最小公倍数为6,方程式为3CuS+8HNO3═3S↓+3Cu(NO3)2+4H2O+2NO↑,故答案为:3CuS+8HNO3═3S↓+3Cu(NO3)2+4H2O+2NO↑;
(2)该反应中,N元素由+5价得电子变为+2价,所以+5价的N元素被还原;通过(1)分析知,HNO3是氧化剂,NO是还原产物,则反应中1mol氧化剂得到3mol电子,
故答案为:+5价的N元素; 3;
(3)该反应中,HNO3是氧化剂,CuS作还原剂;HNO3→NO,N元素由+5价→+2价,一个HNO3得去3个电子;CuS→S,S元素由-2价→0价,生成一个S,需失2个电子,所以其得失电子的最小公倍数为6,方程式为3CuS+8HNO3═3S↓+3Cu(NO3)2+4H2O+2NO↑,所以标出电子转移的方向和数目为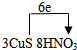 ,故答案为:
,故答案为: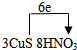 .
.
点评 本题考查了氧化还原反应的配平,要依据氧化还原反应中得失电子数相等进行配平.


科目:高中化学 来源: 题型:选择题
| A. | 砹为有色固体 | B. | AgAt不溶于水 | ||
| C. | HAt 很稳定 | D. | 砹单质熔沸点比碘单质熔沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为226 | B. | 电子数为138 | C. | 中子数为138 | D. | 质量数为314 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的根本原因是胶体有丁达尔效应 | |
| B. | 氯化铁溶液加入到冷水中可以制得氢氧化铁胶体 | |
| C. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| D. | 胶体的分散质可以通过过滤从分散剂中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOCH2Cl | B. | ClCH2CH2OH | C. | CH2ClCHO | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
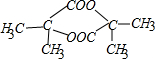 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始量/mol | 平衡量/mo l | 达到平衡所 | ||||||
| 需时间/min | ||||||||
| H2O | CO | H2 | CO | |||||
| 2 | 4 | 1.6 | 2.4 | 5 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量药品时,将砝码置于天平右盘 | |
| B. | 蒸馏实验中,要在烧瓶中加入沸石或碎瓷片,以防止液体暴沸 | |
| C. | 蒸发结晶时,应将蒸发皿中的NaCl溶液全部蒸干才停止加热 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,应冷却至室温再转移到容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com