
 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2)∶n(O2)=2∶1 |
| B.反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C.反应达到平衡时,加入催化剂,速率加快,平衡常数增大 |
| D.当v正(SO2)∶v正(SO3)=1∶1时,说明该化学反应已经达到平衡 |
科目:高中化学 来源:不详 题型:单选题
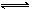 xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
| A.该反应的正反应的△H>0 |
| B.反应进行到5min时,a容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3 。对该反应的有关说法错误的是
2SO3 。对该反应的有关说法错误的是| A.该反应是可逆反应 | B.反应中SO2能全部转化为SO3 |
| C.催化剂能加快该反应的速率 | D.升高温度能加快该反应的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
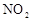 和
和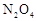 可以相互转化:
可以相互转化: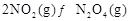 △H<0。现将一定量
△H<0。现将一定量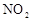 和
和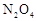 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。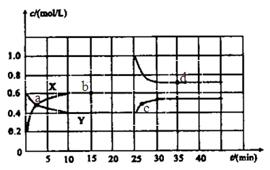
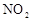 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收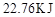 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。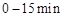 ,反应
,反应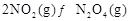 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在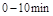 时平均反应速率
时平均反应速率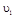 与
与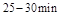 时平均反应速率
时平均反应速率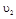 的大小__________。
的大小__________。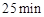 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在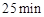 时还可以采取的措施是___________。
时还可以采取的措施是___________。| A.加入催化剂 | B.缩小容器体积 | C.升高温度 | D.加入一定量的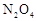 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g)+2D(g),5min后反应达到平衡,容器内压强变小,已知D的平均反应速率为 0.1mol/(L·min),下列结论错误的是
xC(g)+2D(g),5min后反应达到平衡,容器内压强变小,已知D的平均反应速率为 0.1mol/(L·min),下列结论错误的是| A.A的平均反应速率为0.15 mo1/(L·min) | B.平衡时,C的浓度为0.125 mol/L |
| C.平衡时,B的转化率为20% | D.平衡时,容器的压强为原来的10/11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
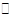 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是| A.①③⑤⑥ | B.②③⑤ |
| C.①③④ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
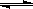 2SO3 达到平衡后,通入
2SO3 达到平衡后,通入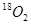 一定时间后,
一定时间后,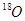 存在于( )
存在于( )| A.SO3、O2 | B.SO2、SO3 | C.SO2、O2 | D.SO2、SO3、O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
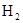 在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇:
在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇: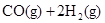

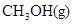 .当CO和
.当CO和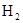 的比例不同时,对CO的转化及平衡混合物中甲醇的含量都有影响.以m表示
的比例不同时,对CO的转化及平衡混合物中甲醇的含量都有影响.以m表示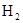 和CO物质的量之比,a为CO的转化率,y为平衡混合物中
和CO物质的量之比,a为CO的转化率,y为平衡混合物中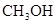 的体积分数,试推导出m,a,y之间的关系式.
的体积分数,试推导出m,a,y之间的关系式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com