
【题目】在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ![]() 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=_________ ,焓变△H_______0(填“>”、“<”或“=”)。
(2)从反应开始到达到化学平衡状态v(A)____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1_______K2(填“>”、“=”或“<”)
(4)可以判断2A(g)+3B(g) ![]() 3C(g) 反应已经达到平衡(____)
3C(g) 反应已经达到平衡(____)
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
【答案】4 > 0.25 < BD
【解析】
(1)2min达平衡,平衡时C为1.5mol,据此利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;根据温度对平衡状态的影响分析判断;
(2)根据v=△n/(V·△t)计算v(C),再利用速率之比等于化学计量数之比计算v(A);
(3)根据温度对平衡状态的影响分析判断;
(4)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变、含量不变,由此衍生的一些物理量也不变,据此结合选项判断。
(1)2min达平衡,平衡时C为1.5mol,C的平衡浓度为1.5mol÷2L=0.75mol/L,则:
2A(g)+3B(g)![]() 3C(g)
3C(g)
开始(mol/L):1 1.5 0
变化(mol/L):0.5 0.75 0.75
平衡(mol/L):0.5 0.75 0.75
故30℃平衡常数k=0.753/(0.52×0.753)=4
由题意可知,升高温度平衡时C的物质的量增大,说明升高温度平衡向正反应方向移动,故正反应为吸热反应,即△H>0;
(2)2min达平衡,平衡时C为1.5mol,C的平衡浓度为1.5mol÷2L=0.75mol/L,用C表示的反应速率是0.75mol/L÷2min=0.375mol/(Lmin)。反应速率之比等于化学计量数之比,所以v(A)=2/3v(C)=2/3×0.375mol/(Lmin)=0.25mol/(Lmin);
(3)升高温度平衡向正反应方向移动,说明温度越高平衡常数越大,故K1<K2;
(4)A.未指明正逆速率,不能说明到达平衡,故A错误;
B.随反应进行,反应混合物的物质的量减小,压强降低,密闭容器中总压强不变,说明到达平衡,故B正确;
C.混合气体的总质量不变,容器的体积不变,容器中混合气体的密度始终不变,不能说明到达平衡,故C错误;
D.混合气体的总质量不变,随反应进行,反应混合物的物质的量减小,混合气体的平均相对分子质量增大,当混合气体的平均相对分子质量不再改变,说明到达平衡,故D正确;
E.平衡时各组分的物质的量之比不一定等于化学计量数之比,与开始的物质的量及转化率有关,当n(A)∶n(B)∶n(C)=2∶3∶3时不能说明到达平衡,故E错误;
故答案为BD。


科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2回收与利用是环境科学家研究的热点课题。利用CO2制备合成气(CO、H2),再制备高值产品,如甲醇等,也可以利用CO2直接制备甲醇等产品。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同条件下,起始反应最快的是____(填序号)。由H2和CO合成气态甲醇的热化学方程式为________。
(2)T1℃下,在2L恒容密闭容器中充入0.20mol CO和0.60mol H2合成CH3OH,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
①T1℃时,以H2表示的反应的平均速率为___,平衡常数K=____。
②(T1+100)℃时,在1L恒容密闭容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此时反应将____(填“向左移动”“向右移动”“达到平衡”或“无法判断”)。
(3)CO2和H2在催化剂作用下反应,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
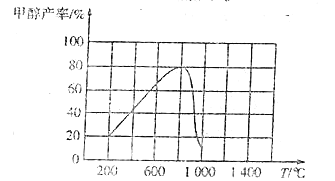
①温度在800℃时甲醇产率最高的主要原因是/span>____。
②下列措施能提高CO2平衡转化率的是____(填字母)。
A.升温 B.加压 C.加入催化剂 D.增大H2浓度
(4)利用电解法在酸性条件下将CO2和H2O转化或CO和H2,阴极反应式之一为CO2+2e-+2H+=CO+H2O,其机理如下:①CO2+2e-+H2O===CO+2OH-(慢反应);②OH-+CO2=HCO3-(快反应);③HCO3-+H+=CO2+H2O(快反应)。其中水的作用是___;控制阴板反应速率的反应是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
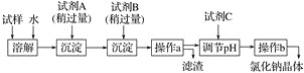
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。

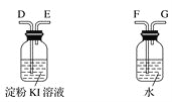
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
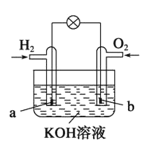
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液,回答下列问题
(1)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、___。
(2)容量瓶上标有刻度线、___,使用前要___。
(3)需用托盘天平称取Na2CO3____g。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线___,
B.溶解后未冷却到室温就转入容量瓶___,
C.容量瓶内壁附有水珠而未干燥处理___,
D.定容时仰视___,
E.上下颠倒摇匀后液面低于刻线___。
(5)若实验室中要用浓度为16mol/L的浓硫酸配制480mL2.0mol/L的稀硫酸,则需要量取浓硫酸的体积为___mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com