
| A. | A2B3 | B. | A6B | C. | AB3 | D. | A3B |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| B. | C-O键的极性比N-O键的极性大 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
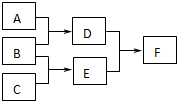 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系:(有部分反应物或者生成物未标出)
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系:(有部分反应物或者生成物未标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/LNa2CO3溶液中有2NA个Na+ | |
| B. | 1L0.1mol/LCuSO4溶液中Cu2+有0.1NA个 | |
| C. | 常温下在PH=1或PH=13的溶液中均不可能有大量的HCO3- | |
| D. | 0.1mol/LCH3COONa溶液的PH=10,则说明CH3COONa是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com