
下列变化过程中表示的能量转化关系错误的是 ( )
A.植物光合作用:光能→生物质能 B.木柴烧饭:生物质能→热能
C.电灯发光:电能→化学能 D.太阳能热水器:光能→热能
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
A.逸出气体的体积a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近出现蓝色
D.a电极附近呈蓝色,b电极附近出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
对某未知有机物进行研究:称取该样品0.352 g,通入足量氧气流充分燃烧,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。下列说法错误的是
A.未知物中碳的质量分数是 41% B.未知物中含有C、H、O元素
C.未知物的实验式为C3H4O3 D.已有条件可确定未知物的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(1)元素⑨的价电子轨道表示式为 ▲ ,元素⑩的次外层电子数为 ▲ 个。
 (2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 ▲ 。
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 ▲ 。
 (3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式 ▲ 。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式 ▲ 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 ▲ 。(填元素代号)
②T元素最可能是 ▲ (填“s”、“p”、“d”、“ds”等)区元素,位于 ▲ 族;
若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:A+3B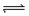 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( )
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( )
A.②>④>③>① B.②>③=④>① C.④>②=③>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于加成反应的是( )
A.CH3Cl+Cl2→CH2Cl2+HCl
B.CH2=CH2+HO-H → HOCH2—CH3
C.CH3COOCH2CH3+H2O  CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
D.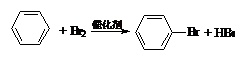
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2 (g) + 3 H2 (g) 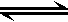 2NH3(g)
2NH3(g)
(1)若反应进行到5min时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a=
(2)用H2的浓度变化表示5min内的平均反应速率为 ;
(3)反应进行到10min时达平衡,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量n(NH3)= 。
(4)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比),n(始)∶n(平) =
II (4分) 将某有机物1.6 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8 g,B管质量增加了2.2 g,该有机物蒸汽的密度是同温同压下氢气的16倍。
(1)燃烧此有机物1.6 g需消耗O2多少g? (2)求此有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②中电子转移的方向和数目:MnO +CuS
+CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。由上述反应得出的物质氧化性强弱的结论是________>________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com