
下列实验的结果不能用于说明实验目的的是
代号 | 实验内容 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯与溴的非金属性强弱 |
B | 向饱和Na2SiO3溶液中通入二氧化碳 | 比较碳与硅的非金属性强弱 |
C | 把碳酸钠与亚硫酸钠放置在空气中 | 比较碳与硫的还原性强弱 |
D | 向氯化铜溶液中加入铁丝 | 比较铁与铜的还原性强弱 |
科目:高中化学 来源:2015-2016学年浙江省高一下十一次联考化学试卷(解析版) 题型:选择题
下列排列顺序不正确的是
A. 热稳定性:H2O>HF>H2S
B. 原子半径:Na>Mg>O
C. 酸性:HClO4>H2SO4>H3PO4
D. 非金属性:F>Cl>Br
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下十一次联考化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是( )
 A.乙烯的结构简式:CH2CH2
A.乙烯的结构简式:CH2CH2
B.对氯甲苯的结构简式: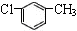
C.CH2ClCH2Cl的名称:二氯乙烷
D.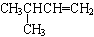 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东济宁微山一中高二下第二次月考化学试卷(解析版) 题型:选择题
下列事实不能用平衡移动原理解释的是( ) 
A.工业合成氨时使用催化剂
B.配制FeCl3溶液时加入少量的盐酸
C.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:实验题
某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:

试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有 。
(3)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为合理的是__________,理由________________;
写出A→D反应离子方程式:____________________________。
(4)操作③的名称是_________________。
(5)丙同学提出可将方案中最初溶解合金的试剂①改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案比原方案是否更合理: ,理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
在下列各组离子中,能大量共存的是
A.Al3+、NH4+、AlO2-、Cl-
B.Cu2+、Fe2+、ClO-、SO42-
C.Na+、Ca2+、HCO3-、OH-
D.Cu2+、Fe3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:填空题
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
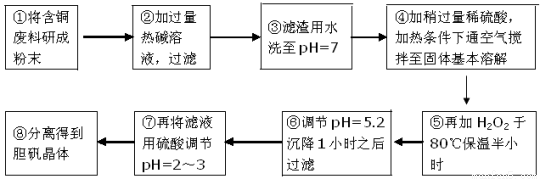
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列叙述I和叙述II均正确且有因果关系的是( )
选项 | 叙述I | 叙述II |
A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二实验班下期中化学卷(解析版) 题型:推断题
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com