
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
【答案】SnCl4+3H2O=H2SnO3+4HCl 增大接触面积,加快反应速率 60 1-3% 抑制水解,且浓度过大生成SnCl4 SnCl2+Cl2=SnCl4 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 95.2%
【解析】
将金属锡熔融,然后泼入冷水,激成锡花,与氯气反应生成SnCl4,蒸馏后再加入锡粉,得到SnCl2溶液,过滤后,蒸发浓缩冷却结晶,过滤洗涤得到二水氯化亚锡晶体,
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),还生成HCl;
(2)将金属锡熔融,然后泼入冷水,激成锡花,增大接触面积;
(3)2h、60℃时转化率较大,且温度升高促进水解;
(4)图中1-3%浓度的盐酸时结晶率大;
(5)反应釜中SnCl2与反应Cl2生成SnCl4;
(6)发生6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O;
(7)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~K2Cr2O7,据此计算。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),该反应的化学方程式为SnCl4+3H2O=H2SnO3+4HCl,
故答案为:SnCl4+3H2O=H2SnO3+4HCl;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是增大接触面积,加快反应速率,
故答案为:增大接触面积,加快反应速率;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为60℃,
故答案为:60;
(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为1-3%,原因为抑制水解,且浓度过大生成SnCl4,
故答案为:1-3%;抑制水解,且浓度过大生成SnCl4;
(5)反应釜中发生反应的化学方程式为SnCl2+Cl2=SnCl4,
故答案为:SnCl2+Cl2=SnCl4;
(6)K2Cr2O7滴定②中生成的Fe2+,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(7)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~K2Cr2O7
119g mol
1.125g×x 0.100mol/L×0.03L
解得x=95.2%,
故答案为:95.2%。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
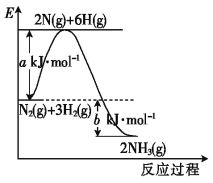
【题目】(1)已知:P4(s)+6Cl2(g)![]() 4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)
4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)![]() 4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
(2)工业合成氨时,合成塔中每生成1molNH3放出46kJ的热量。其反应过程的能量变化如图。b值为________kJ。加入催化剂,a值____(填“增大”“减小”或“不变”,下同)。压缩容器体积,b值___。
(3)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是

A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 | 氧化物 | 环境问题 | 主要来源 |
A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
B | SO2 | 温室效应 | 汽车尾气的排放 |
C | NO2 | 光化学烟雾 | 工厂废气的排放 |
D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。每位考生只可选做1题,若两题都作答,则以A题计分。
A.《化学与生活》
(1)材料与人类吃、穿、住、行、用、医疗、通信等密切相关
①下列分子式或结构简式可表示维生素C的______(填字母)。
a.C6H8O6 b.C6H10O6 c.
②玻璃钢门窗被国际上称为继木、钢、铝、塑之后的第五代门窗产品。玻璃钢属于下列材料中的____(填字母)。
a.金属材料 b.无机非金属材料 c. 复合材料
③黏土是陶瓷的生产原料,其主要组成可表示为Al2Si2Ox(OH)4,则x=______(填字母)。
a.1 b.3 c.5
(2)绿色发展可使 “天更蓝,水更清,空气更清新,生活更美好”。
①传统的一次性塑料袋有聚氯乙烯、氯乙烯等,它们在环境中难降解易造成白色污染,合成聚氯乙烯的单体为_____(写结构简式)。
②燃煤产生的NO2是形成硝酸型酸雨的元凶,在催化剂及加热条件下用NH3与NO2反应可生成无毒无污染的气体,该反应的化学方程式为______。
③含铬(Cr2O72ˉ)的酸性废水处理方法之一可采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和______。处理后的废水中因含有大量_____(填离子符号),能导致水体富营养化,还需进一步处理。
(3)保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
①有些氨基酸人体自身不能合成,要从外界才能获得,这些氨基酸称为________。苹果中含有一定量的铁元素,人体缺铁会导致的疾病是_____。
②含碘食盐中添加有KIO3,可用KI、盐酸及淀粉溶液检验,该反应的离子方程式为_______。
③人类历史上最重要的抗生素是_____(填名称);“铝镁加”是一种新型的抗酸剂,它的主要成分的化学式为:Al2Mg6(OH)14(CO3)2·4H2O,它与胃酸主要成分反应的化学方程式为______。
B.《有机化学基础》
(1)有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是____(填字母)。
a. 乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c. HCOOCH3
(2)芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:

①化合物Ⅱ中含氧官能团为____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
(3)囧烷(E)的一种合成路线如下:
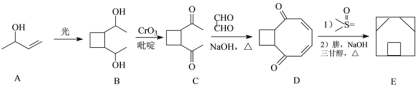
①A→B的反应类型为_____;B中手性碳原子数目为_____(填数字)。
②E的分子式______;A可用于合成一种常见的人造橡胶的单体,由A制备该单体的化学方程式为______。
③满足下列条件的D的同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3∶3∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
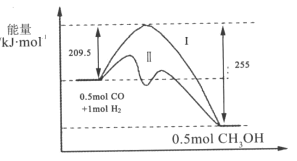
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
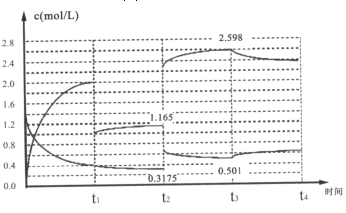
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃结构简式为 ,其命名正确的是
,其命名正确的是
A. 2-乙基-3,3-二甲基戊烷 B. 3,3-二甲基-4-乙基戊烷
C. 3,3,4-三甲基己烷 D. 3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量铝粉分别与下列4种等体积的溶液充分反应,放出氢气最多的是( )
A.3mol·L-1H2SO4溶液B.18mol·L-1H2SO4溶液
C.1.5 mol·L-1KOH溶液D.3mol·L-1HNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com