
�ڰ��Ĺ�ҵ�ϳ��У��������ؼ��ļ������⣬������ѧ֪ʶ������ǣ�
(1)�ϳɰ��Ļ�ѧԭ����N2+3H2 ![]() 2NH3���ڹ�ҵ��ѡ��20�D50MPa�Ľϸ�ѹǿ�� 500
2NH3���ڹ�ҵ��ѡ��20�D50MPa�Ľϸ�ѹǿ�� 500![]() ���¶������з�Ӧ�������йصĻ�ѧԭ�����͡�
���¶������з�Ӧ�������йصĻ�ѧԭ�����͡�
(2)��������������Ҫ�����������������¼��ֻ�������ķ���������ѡ�������˵ģ���˵�����ɡ�
A�����ˮ��ȡ������B����ú��̼����ȡ������ú��̼�����ȣ����ȵ�̿��ˮ������Ӧ����������C������Ȼ����������ȡ��������Ȼ������Ҫ�ɷּ����ڸ��¡���������������ˮ������Ӧ����������һ����̼��һ����̼�ڴ������ڵ���������ˮ������Ӧ�õ������Ͷ�����̼��
(3)�ϳɰ��������������̣��������ʵ��ķ����������ϳɰ���ԭ����һһ������������
�����������Ļ�������ںϳ���һ�������£�ͨ����Ťl�����ò�����������ͨ�������������ϵذ����ɵİ����������ͬʱδת���ķ�Ӧ�����ٽ���ϳ���ѭ���ӹ�������Ǻϳɰ��Ĺ������̡��������һ�������̻������̷���ͼ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
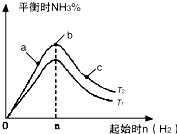 ����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺| t/s | 0 | 500 | 1000 |
| c��N2O5��/mol?L-1 | 5.00 | 3.52 | 2.48 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
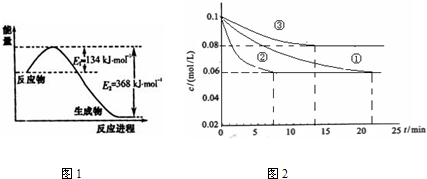
| ||
| (һ������) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c��N2O3��/mol?L-1 | 5.00 | 3.52 | 2.48 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���ս̰���л�ѧѡ��2 2.1���ĺϳ���ϰ���������棩 ���ͣ������
�ڰ��Ĺ�ҵ�ϳ��У��������ؼ��ļ������⣬������ѧ֪ʶ������ǡ�
(1)�ϳɰ��Ļ�ѧԭ����N2��3H2??2NH3���ڹ�ҵ��ѡ��20��50 MPa�Ľϸ�ѹǿ��450 �����ҵ��¶������з�Ӧ�������йصĻ�ѧԭ�����͡�
(2)��������������Ҫ�����������������¼��ֻ�������ķ���������ѡ�������˵ģ���˵�����ɡ�
A�����ˮ��ȡ����
B����ú��̿����ȡ������ú��̿�����ȣ����ȵ�̿��ˮ������Ӧ��������
C������Ȼ����������ȡ��������Ȼ������Ҫ�ɷּ����ڸ��¡���������������ˮ������Ӧ����������һ����̼��һ����̼�ڴ������ڵ���������ˮ������Ӧ�õ������Ͷ�����̼
(3)�ϳɰ��������������̣��������ʵ��ķ����������ϳɰ���ԭ�������������������������������Ļ�������ںϳ�������һ�������£�ͨ�����������ò�����������ͨ�������������ϵذ����ɵİ����������ͬʱδת���ķ�Ӧ�����ٽ���ϳ���ѭ���ӹ�������Ǻϳɰ��Ĺ������̡��������һ�������̻������̷���ͼ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com