
【题目】按要求书写名称或结构简式:
(1)羟基的电子式;
(2)﹣C3H7结构简式:、;
(3)![]() 的系统命名为;
的系统命名为;
(4)相对分子质量为72且支链最多的烷烃的结构简式
(5)键线式 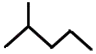 表示的分子式;名称是 .
表示的分子式;名称是 .
【答案】
(1)![]()
(2)﹣CH2CH2CH3;﹣CH(CH3)2
(3)3﹣甲基戊烷
(4)
(5)C6H14;2﹣甲基戊烷
【解析】解:(1)羟基为﹣OH,O原子周围有7个电子,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)丙烷存在两种“等效氢“,分别去掉一个等效氢后剩下的部分为丙基,结构式为:﹣CH2CH2CH3或﹣CH(CH3)2 ,
;(2)丙烷存在两种“等效氢“,分别去掉一个等效氢后剩下的部分为丙基,结构式为:﹣CH2CH2CH3或﹣CH(CH3)2 ,
所以答案是:﹣CH2CH2CH3;﹣CH(CH3)2;(3)最长的碳链为含有甲基的链,有5个碳原子,所以该有机物的名称为:3﹣甲基戊烷,
所以答案是:3﹣甲基戊烷;(4)14n+2=72,解得n=5,
所以该烷烃的分子式为C5H12 ,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3 ,
主链有4个碳原子的: ![]() ,
,
主链有3个碳原子的:  ;
;
故支链最多的结构简式为  ,所以答案是:
,所以答案是:  ;(5)
;(5) ![]() 分子中含有6个碳原子,属于饱和烃,分子式为C6H14 , 该有机物主链上有5个C,2号C一个甲基,结构简式为:(CH3)2CHCH2CH2CH3 , 命名为:2﹣甲基戊烷,
分子中含有6个碳原子,属于饱和烃,分子式为C6H14 , 该有机物主链上有5个C,2号C一个甲基,结构简式为:(CH3)2CHCH2CH2CH3 , 命名为:2﹣甲基戊烷,
所以答案是:C6H14;2﹣甲基戊烷.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O; ②2SO2+SeO2+2H2O===Se+2 SO42-+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是__________,还原剂是___________,反应中被还原的元素是________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________________________________________________________。
(3)用双线桥法标出反应②电子转移的方向和数目:_____________________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O
配平上述反应的化学方程式。________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述错误的是
A. 干电池工作时将化学能转化为电能B. 医用酒精是纯酒精
C. 食盐溶解于水时破坏了化学键D. 人工固氮是氮的循环的一部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 .
A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O9.4g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+ , 最好往废液中通入足量的,再加入碱液,调节pH至少为才能使铬的离子沉淀完全(铬的离子浓度应小于10﹣5mol/L).【已知Cr(OH)3的溶度积为6.3×10﹣31 , ![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨﹣水体系中不断通入CO2 , 各种离子的变化趋势如图所示.下列说法不正确的是( ) 
A.在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣)
C.随着CO2的通入, ![]() 不断增大
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com