
【题目】有一镁铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量与加入氢氧化钠的体积关系如图所示,原合金中镁铝的质量比为

A. 4:9 B. 4:3 C. 8:9 D. 20:27
【答案】A
【解析】镁铝合金加入稀硫酸发生的反应为:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑;加入NaOH溶液发生的反应为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4、Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4、Al(OH)3+NaOH=NaAlO2+2H2O,由方程式可见Al2(SO4)3完全沉淀和生成的Al(OH)3完全溶解消耗的NaOH溶液的体积比为3:1;由图可见Al(OH)3完全溶解消耗1体积NaOH溶液,Al2(SO4)3完全沉淀消耗3体积NaOH溶液,MgSO4完全沉淀消耗的NaOH溶液为4-3=1体积;根据Mg、Al守恒和反应方程式,n(Mg):n(Al)=![]() :1=1:2,m(Mg):m(Al)=24:(2
:1=1:2,m(Mg):m(Al)=24:(2![]() 27)=4:9,答案选A。
27)=4:9,答案选A。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO﹣+H2OCH3COOH+OH﹣ , 使得溶液中的c(OH﹣)>c(H+)
B.在常温下,10 mL 0.2 molL﹣1盐酸与10 mL 0.2 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
C.在0.1 molL﹣1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl﹣)
D.5 mL 1 molL﹣1 CH3COONa溶液与5 mL 1 molL﹣1盐酸混合液中c(Cl﹣)=c(Na+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),湿法炼铜工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为________________________________.
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为__________________________________________________
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3·H2O+O2+OH-→ Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)用化学用语解释氨水溶液的酸碱性______________________________.
(3)生产中为了稳定溶液的pH,可以在浸出液加入___________________(物质名称)Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
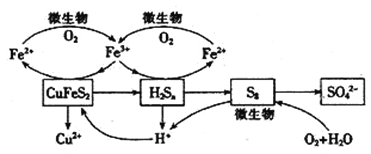
(4)在微生物的作用下,可以循环使用的物质有_________(填化学式),微生物参与的离子反应方程式为_______________________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O==2H++Cl-+ClO-
B. 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2
C. 酸性溶液中KBrO3与KBr反应生成Br2:BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+ Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W是地壳中含量居第二位的元素,且X、Y、Z、W在元素周期表中的位置如图所示。下列说法正确的是
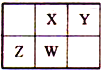
A. 最高正化合价:Z>X=W>Y B. 原子半径:Y>X>W>Z
C. 最高价氧化物对应水化物的酸性:Z<W<X<Y D. 最高价含氧酸的钠盐溶液能与CO2反应的元素:X、Y、Z、W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现强氧化性,又表现酸性的是
①2NaC1(固)+ H2SO4(浓) ![]() Na2SO4+2HC1↑
Na2SO4+2HC1↑
②C +2H2SO4(浓) ![]() CO2↑+ 2SO2↑+2H2O
CO2↑+ 2SO2↑+2H2O
③Cu+2H2SO4(浓) ![]() CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
④2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
A. ①② B. ③④ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
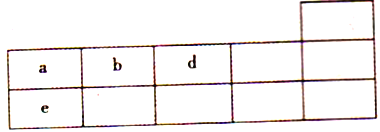
(1)a原子结构示意图为___________,d的一种氢化物为常见溶剂,其电子式为__________。
(2)e的最高价氧化物对应水化物的钠盐液中通入少量a的最高价氧化物会发生反应,写出相应的离子方程式:____________________________________。
(3)X、Y为同周期元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两种元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的化学方程式:____________________________,X在周期表中的位置为________________。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与a、W的单质在高温条件下反应,每消耗6kg a的单质,过程中转移1×103mol电子,写出相应反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”“PM2.5”已成为电视、新闻热词,下列做法不符合“环境友好”的是( )
A.使用清洁能源,减少煤的燃烧
B.减轻交通压力,提倡私家车出行
C.道路、建筑工地定期喷洒水,减少扬尘
D.种植沙漠防护林,减少沙尘暴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体
A.①和②B.①和③C.③和④D.①和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com