
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是 ( )。
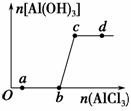
A.a点对应的溶液中:Na+、Fe3+、SO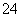 、HCO
、HCO
B.b点对应的溶液中:Na+、S2-、SO 、Cl-
、Cl-
C.c点对应的溶液中:Ag+、Ca2+、NO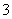 、F-
、F-
D.d点对应的溶液中:K+、NH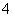 、I-、CO
、I-、CO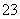
科目:高中化学 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
海水
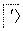





(1)步骤③的离子方程式:_________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:________________________________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是___________ __________________________________________________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是 ( )。
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Cu都是用热还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
将几滴KSCN(SCN-是“类卤离子”)溶液加入到硫酸酸化的硫酸铁溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是 ( )。
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法中错误的是 ( )。
A.MgO、Al2O3的熔点很高,可制作耐高温材料,工业上也用其电解冶炼对应的金属
B.明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化
C.燃放烟花是利用了某些金属元素的焰色反应
D.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
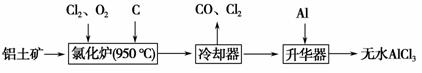
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为_____________________ _________________________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为_______________________________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________ _____________________________________________________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式:__________________________、__________________________。
②AlCl3产品的纯度为__________。
(5)工业上另一种以铝灰为原料制备无水AlCl3的工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是__________________ ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是 ( )。
| Na2O2/mol | NaHCO3/mol | 剩余的固体物质 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2 Na2CO3 |
| C | 2 | 1 | Na2O2 NaOH Na2CO3 |
| D | 2 | 2 | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为SO2+2Fe3++2H2O===SO +2Fe2++4W ①,Cr2O
+2Fe2++4W ①,Cr2O +aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
A.还原性:Cr3+>SO2
B.方程式②中,a=6,b=7
C.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
D.方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O2-7的物质的量为 mo1
mo1
C.反应中发生转移的电子的物质的量为6nx mol
D.在FeO·FeyCrxO3中3x=y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com