
【题目】根据表提供的数据,下列判断正确的是
弱酸化学式 | CH3COOH | HClO | H2CO3 |
电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A![]() H++HA-;HA-
H++HA-;HA-![]() H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
【答案】D
【解析】A、根据电荷守恒规律,等物质的量的Na2CO3和CH3COOH两种溶液混合一定有c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)+ c(HCO3-)+2 c(CO32-),选项A错误;B、H2A为二元弱酸,则NaHA溶液的酸碱性未知,HA-的水解与电离程度的强弱无法判断,所以NaHA溶液中水的电离程度与纯水中水的电离程度无法比较,选项B错误;C、 根据电离平衡常数可知,醋酸的酸性大于次氯酸,所以同浓度的醋酸钠与次氯酸钠的混合液中次氯酸根离子的水解程度大于醋酸根离子的水解程度,溶液呈碱性,则溶液中离子的浓度关系是c(Na+)> c(CH3COO-)> c(ClO-)> c(OH-)>c(H+),错误;D、常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当 c(CH3COOH):c(CH3COO-)=5:9时,根据醋酸的电离常数K=1.8×10-5= 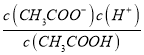 ,则c(H+)=1×10-5mol/L,所以溶液的pH=5,选项D正确。答案选D。
,则c(H+)=1×10-5mol/L,所以溶液的pH=5,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:
![]()
![]()
![]()
![]()
![]()
(1)若甲是CO2。
①常用于泡沫灭火器的是________(填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是__________。
(2)若甲是Al。
①Al的原子结构示意图为___________。
②当n(Al)∶n(NaOH)∶n(H2SO4)=1∶1∶2时,丙的化学式是__________。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是_________________________。
②常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=____________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 mol蔗糖可以水解生成2 mol葡萄糖
B. 异戊烷的一氯代物只有一种
C. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D. 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某试剂瓶上贴有标签如下,完成以下问题:

(1)该“84消毒液”的物质的量浓度约为_______________mol·L﹣1(小数点后保留一位).
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制500mL含NaClO质量分数为37.25%的消毒液.需要称量NaClO固体的质量为________g
(3)某同学取100mL该“84消毒液”,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为________。
(4)配制上述“84消毒液”时,其正确的操作顺序是(每个操作只用一次):_________.
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
G.用天平称量该物质
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:_____________.
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视容量瓶刻度线
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.转移溶液时未洗涤烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段。
(1)飞机的外壳通常采用镁-铝合金材料,铝的价电子排布图为 ,第一电离能:镁 (填“大于”或“小于”)铝。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:
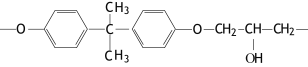
其中碳原子的杂化方式为 ,个数比为 。
II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料。
(3)钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式 ;
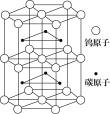
(4)下图为碳化钨晶体的一部分结构, 碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有 个,1个钨原子周围距离钨原子最近的碳原子有 个 ,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是 。
A. Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(5)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释。平衡时的pH随溶液体积变化的曲线如图所示。下列说法正确的是
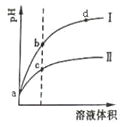
A. 曲线Ⅱ对应氯化铵溶液
B. 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大
C. b点比c点水的电离程度大
D. c、d两点的离子积常数不等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质之间的反应与对应的反应类型不相符的是
A.乙烯与溴水——加成反应B.苯与浓硝酸、浓硫酸混合酸——取代反应
C.乙醇与钠——置换反应D.甲烷与氧气(点燃)——化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com