
(12分) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为: 。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入 。(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4 溶液液面下,再挤出NaOH溶液,这样操作的理由是 。
(4)检验Fe3+存在的最佳试剂是 ,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。


血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式 。
⑵血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。

查看答案和解析>>
科目:高中化学 来源:2013届浙江省宁波市高二5月月考化学试卷(解析版) 题型:填空题
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
— |
— |
|
沉淀完全的pH |
12.4 |
8.0 |
— |
— |
|
开始溶解的pH |
— |
10.5 |
— |
— |
|
Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。

(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期第一次统练化学试卷 题型:填空题
(14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
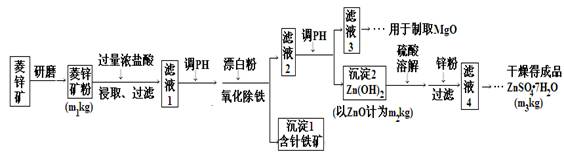
(1)将菱锌矿研磨成粉的目的是 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
— |
— |
|
沉淀完全的pH |
12.4 |
8.0 |
— |
— |
|
开始溶解的pH |
— |
10.5 |
— |
— |
|
Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)工业上从“滤液3”制取MgO过程中,最合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省苏州市高三上学期10月份月考化学试卷 题型:填空题
(12分) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。
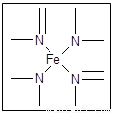
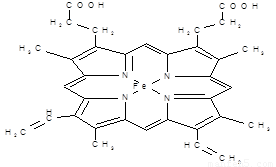
血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式 。
⑵血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
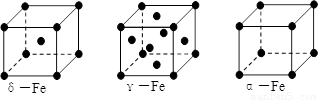
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com