
【题目】KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:
①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液进行处理可获得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是___________________。
(2)写出第②步中发生反应的离子方程式____________。
(3)第③步中从滤液中获得KMnO4晶体的方法是______、_______、过滤、洗涤、干燥。
(4)取上述制得的KMnO4产品2.0000g,溶于水配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00mL。
①滴定终点的现象是_____________。
②计算KMnO4产品的纯度。(写出计算过程)_____________
【答案】将③中MnO2回收利用3MnO42-+4H+=MnO2↓+2MnO4-+2H2O蒸发浓缩降温结晶当加入最后一滴标准Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色79%
【解析】
(1)将步骤③中MnO2回收,再发生步骤①中的反应,可以提高MnO2利用率;
(2)根据反应物与生成物来书写反应方程式;
(3) 第③步中从滤液中获得KMnO4晶体的方法是蒸发浓缩、降温结晶、过滤、洗涤、干燥;
(4)根据滴定原理分析终点现象,利用反应方程式及Na2S2O3的量来计算KMnO4产品的纯度。
(1)将步骤③中MnO2回收,再发生步骤①中的反应,可以提高MnO2利用率;
因此,本题正确答案是:将③中MnO2回收利用;
(2)由滤液酸化后,K2MnO4完全转变为MnO2和KMnO4,则反应的离子方程式为3MnO42-+4H+=MnO2↓+2MnO4-+2H2O,
因此,本题正确答案是:3MnO42-+4H+=MnO2↓+2MnO4-+2H2O;
(3) 第③步中从滤液中获得KMnO4晶体的方法是蒸发浓缩、降温结晶、过滤、洗涤、干燥,因此,本题正确答案是:蒸发浓缩;降温结晶;
(4) ①碘与淀粉显蓝色,则滴定终点的现象是当加入最后一滴标准Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色,
②消耗硫代硫酸钠的物质的量n=cV=0.025L![]() 0.02L=0.005mol,根据得失电子守恒知高锰酸钾的物质的量=0.005mol
0.02L=0.005mol,根据得失电子守恒知高锰酸钾的物质的量=0.005mol![]() 5=0.001mol,
5=0.001mol,
所以m(KMnO4)=nM=0.001mol×158g/mol=0.158g,
KMnO4产品的纯度为:![]() ×100%=79%;
×100%=79%;
因此,本题正确答案是:当加入最后一滴标准Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色;79%。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设
CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设![]() =Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
=Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
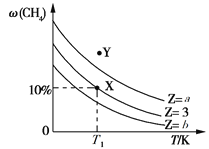
A. a>3>b
B. 保持温度不变,平衡体系加压后ω(CH4)增大
C. 温度为T1、Z=3时,Y点所对应的反应向逆反应方向进行
D. X点时,H2的体积分数为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需用坩埚钳夹取加热后的蒸发皿
B. 容量瓶使用前无需检漏
C. 蒸馏实验结束后,先停止通冷凝水,再停止加热
D. 焰色实验所用的铂丝,每次用完后都要用稀硫酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________个H原子。
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为__________。
(3)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = _________mol/L。
(4)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr 。若反应中生成了 0.2 mol HBr,则消耗SO2的体积(标准状况)是________________L。
(5)当SO2、SO3的分子个数之比为1:2时,原子总数之比为___________,质量之比为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则一定有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论有错误的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 证明氧化性:Cl2>Br2,但不能证明氧化性:Br2>I2 |
C | 向某溶液中加入硝酸银溶液 | 产生白色沉淀 | 则溶液有氯离子 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有不稳定性 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com