
| A. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 滴定到终点读数时,发现滴定管尖嘴内有气泡 | |
| D. | 配制标准溶液的NaOH中混有KOH杂质 |
分析 根据c(待测)=$\frac{c(标准)•V(标准)}{c(待测)}$分析不当操作对V(标准)的影响,如果标准液体积偏大、浓度偏大或待测液体积偏小,都会导致测定结果偏高,据此进行解答.
解答 解:A.锥形瓶不能润洗,该操作方法合理,不影响滴定结果,故A错误;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致V(标准)偏小,则结果偏低,故B错误;
C.滴定到终点读数时,发现滴定管尖嘴内有气泡,导致消耗的标准液体积偏小,测定结果偏低,故C错误;
D.所用的固体NaOH中混有KOH,由于KOH的摩尔质量较大,所配得溶液的OH-浓度偏小,即标准液浓度偏低,滴定时消耗V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{c(待测)}$可知c(酸)偏高,故D正确;
故选D.
点评 本题考查中和滴定,题目难度中等,明确中和滴定操作方法为解答关键,试题有利于提高学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
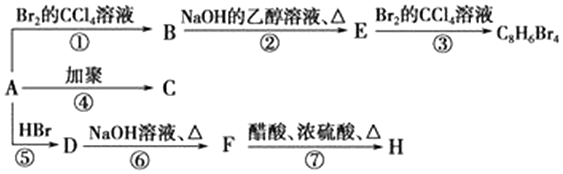
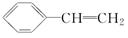 .
.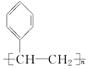 ,D
,D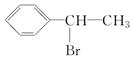 ,E
,E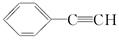 ,H
,H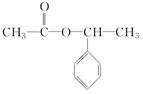 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.写出⑦反应的化学方程式
+NaBr.写出⑦反应的化学方程式 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$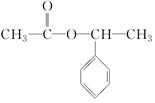 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,1molCH4和2molCH4的燃烧热不同,后者是前者的2倍 | |
| B. | 对于一个确定的反应,反应热的大小与反应路径有关 | |
| C. | 对于反应CaCO3(s)═CaO(s)+CO2(g)△H=+178.2kJ/mol,在高温下才能发生分解,说明能量变化是物质变化的基础 | |
| D. | 化学平衡常数(K)的大小反映了化学反应进行的程度,K值越大,反应物的转化率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
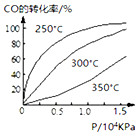 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
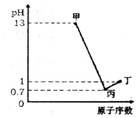 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验用品(省略夹持装置) | 相应实验 |
| A | 蒸发皿、玻璃棒、泥三角、三脚架 | 从食盐水中获得NaCl晶体 |
| B | 烧杯、玻璃棒、漏斗、滤纸 | 除去氢氧化铝胶体中的泥沙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用胆矾配制100mL0.1mol/L的硫酸铜溶液 |
| D | 蒸馏烧瓶、温度计、冷凝管、石棉网、牛角管、锥形瓶、酒精灯 | 用四氯化碳萃取溴水中的溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 mol | B. | 0.16 mol | C. | 0.24 mol | D. | 0.32mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com