
【题目】氮的化合物在生产生活中广泛存在。
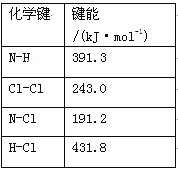
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
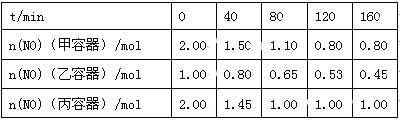
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
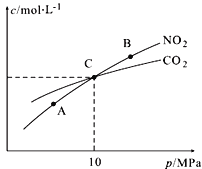
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1)①![]() (2分);+11.3 kJmol-1
(2分);+11.3 kJmol-1
②NH2Cl+H2O![]() NH3+HClO
NH3+HClO
(2)①放热;
②0.003 molL-1min-1
(3)①=
②A
③2 MPa
【解析】
试题分析:(1)①氯胺(NH2Cl)为共价化合物,电子式为:![]() ;制备氯胺的反应为:NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),根据化学反应的焓变等于反应物键能总和减去生成物键能总和可知:该反应的ΔH=(391.3×3+243.0) kJ·mol-1-(391.3×2+191.2+431.8) kJ·mol-1=+11.3 kJmol-1。
;制备氯胺的反应为:NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),根据化学反应的焓变等于反应物键能总和减去生成物键能总和可知:该反应的ΔH=(391.3×3+243.0) kJ·mol-1-(391.3×2+191.2+431.8) kJ·mol-1=+11.3 kJmol-1。
故答案为:![]() ;+11.3 kJmol-1;
;+11.3 kJmol-1;
②根据题意可知NH2Cl与水反应生成强氧化性的物质HClO,可作长效缓释消毒剂,所以该反应的化学方程式为:NH2Cl+H2O![]() NH3+HClO。
NH3+HClO。
故答案为:NH2Cl+H2O![]() NH3+HClO;
NH3+HClO;
(2)①依据表中数据可知,该反应在T℃时反应速率快,达到平衡状态时n(NO)减小。则T>400,且随着温度升高,平衡向逆反应方向移动,说明该反应为放热反应。
故答案为:放热;
②根据2NO(g)+C(s)![]() N2(g)+CO2(g)可知,该反应过程中压强不变,甲、乙两容器到达平衡状态为等效平衡。所以乙容器在200min达到平衡状态时n(NO)=0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=
N2(g)+CO2(g)可知,该反应过程中压强不变,甲、乙两容器到达平衡状态为等效平衡。所以乙容器在200min达到平衡状态时n(NO)=0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=![]() = 0.003molL-1min-1。
= 0.003molL-1min-1。
故答案为:0.003 molL-1min-1
(3)①反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g)在恒温条件下进行,化学平衡常数只与温度有关,所以Kc(A) = Kc(B).
N2(g)+2CO2(g)在恒温条件下进行,化学平衡常数只与温度有关,所以Kc(A) = Kc(B).
故答案为:=;
②A、B、C三点中达到平衡状态后A点NO2浓度最小,所以NO2的转化率最高。
故答案为:A;
③由焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=
=4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=![]() =2MPa。
=2MPa。
故答案为:2MPa。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】[2016江苏]大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是
A.燃烧煤炭供热 B.利用风力发电
C.增加植被面积 D.节约用水用电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某甲醇燃料电池的总反应式2CH4O + 3O2= 2CO2+ 4H2O,下图是该燃料电池的示意图。下列说法正确的是

A. a是甲醇燃料、b是氧气
B. 当转移6mole-时,消耗33.6LO2
C. 负极反应:CH4O - 6e-+ H2O = CO2↑+ 6H+
D. 质子从N电极区穿过交换膜移向M电极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温下7.2gCaO2晶体中阴离子和阳离子总数为0.3NA
B. 1mol/L的氯化铁溶液中,若CI-的数目为3NA,则Fe3+的数目为NA
C. 反应3H2(g)+N2(g)2NH3(g) ΔH=-92KJ/mol,当放出热量9.2KJ时,转移电子0.6NA
D. 标准状况下,11.2L三氯甲烷中含有含极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L 1mol/L的氨水中,下列有关说法正确的是
A.NH3·H2O为1mol ,溶质质量为35g
B.NH4+为1mol ,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )

A. 电池的负极反应为BH4--8e-+8OH-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 电子从电极a经外电路流向电极b
D. 放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
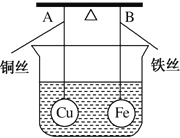
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com