
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)∆H1<0
N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)∆H1<0
②N2O2(g)+O2(g) 2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)∆H2
2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)∆H2 <0
<0
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的∆H= (用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的∆H= (用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)决定2NO(g)+O2(g) 2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。

A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
由实验数据得到v2正~[O2]的关系可用右图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为 (填字母)。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3·H2O=NH4NO3+NH4NO2+H2O。若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+) c(NO3-)+c(NO2-)(填“>”“<”或“=”)。工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。
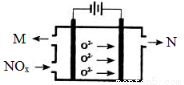
该电解池阴极的电极反应式是 。阳极产生的气体N的化学式是 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:实验题
某学生为测定未知浓度的硫酸溶液(已知滴定时供选择的指示剂有石蕊、酚酞),实验如下:用1.00m L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是 。
②该滴定操作中应选用的指示剂是 。
③在G操 作中如何确定终点? 。
作中如何确定终点? 。
(2)酸式滴定管用蒸馏水润洗后,未用待测液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (填“甲”或“乙”)中。
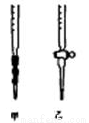
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算 结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
在研究钠的性质时:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。本实验采用的研究方法是( )
①假说法 ②实验法 ③分类法 ④比较法
A.①②③④ B.①③ C.②④ D.①②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点(两曲线交点)时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(OH-)和c(H+)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
下表中,甲、乙、丙、丁、戊分别代表一种物质,在一定条件下相邻的物质间能发生反应,不相邻物质间不能发生反应的有哪几组
组别 | 甲 | 乙 | 丙 | 丁 | 戊 |
① | SiO2 | CaCO3 | 稀HNO3 | Fe | CuSO4溶液 |
② | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
③ | Cl2 | H2S | 稀HNO3 | Al(OH)3 | NaOH溶液 |
④ | CO2 | Mg | 稀HCl | CaO | Na2CO3溶液 |
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:选择题
25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH) =10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.V(NaOH) =20.00mL时,两溶液中 c(CH3COO-)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
对于合成氨反应N2(g)+3H2(g)  2NH3(g)△H=-92 kJ/mol,下列说法正确的是( )
2NH3(g)△H=-92 kJ/mol,下列说法正确的是( )
A.若起始加入2molN2和6molH2发生反应,则平衡时N2和H2的转化率相同
B.该反应采用高温条件,有利于提高NH3的产率,从而提高生产效率
C. 若起始加入2molN2和6molH2发生反应,平衡时共放热46kJ,则N2的平衡转化率为50%
D.若平衡时保持其它条件不变,压缩容器体积,则平衡正向移动,N2的浓度减小,NH3的浓度增大
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是 ( )
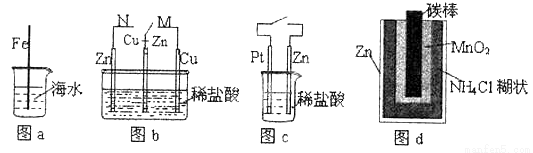
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图d中,Zn - MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图b中,开关由M改置于N时,cu-zn合金的腐蚀速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com