

| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:填空题
 .
.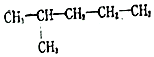 2-甲基戊烷
2-甲基戊烷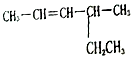 4-甲基-2-己烯.
4-甲基-2-己烯.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
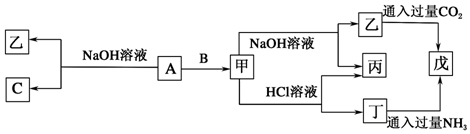
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
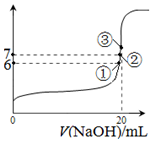 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 使用正催化剂、升高温度、增大反应物浓度,都可以增大正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | I- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com