
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
| c |
| 2-c |
| 1mol/L |
| 2mol/L |
| c(CO) |
| c(CO2) |
| c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| K1 |
| K2 |
| 2.4 |
| 1.6 |


科目:高中化学 来源: 题型:
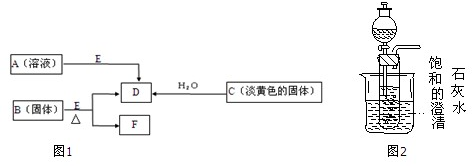
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置所示,C、D、E、F都是惰性电极,
如图装置所示,C、D、E、F都是惰性电极,查看答案和解析>>
科目:高中化学 来源: 题型:
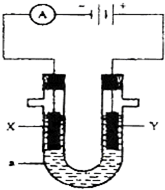 如图为电解装置,X、Y为电极材料,a为电解质溶液.
如图为电解装置,X、Y为电极材料,a为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
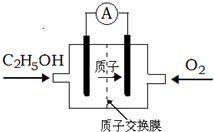 一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是| A、放电过程中,电源内部的H+从正极区向负极区迁移 |
| B、通入乙醇的电极是负极 |
| C、该电池的正极反应为:4H++O2+4e-=2H2O |
| D、用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2 |
| B、pH=12 |
| C、由水电离产生的c(H+)=1.0×10-2 mol?L-1 |
| D、溶质的物质的量浓度为0.02 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2+CO2═CaCO3↓+H2O | ||||
B、CO2+C
| ||||
C、2Fe2O3+3C
| ||||
D、C+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com