
| 0.01mol•L-1����Һ | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
���� X��Y��Z��W�ֱ���HNO3��NH4NO3��NaOH��NaNO2����ǿ������е�һ�֣�0.01mol/L��X��ҺpH=12��˵��XΪǿ���XΪNaOH��
0.01mol/L��Y��ҺpH=2��˵��YΪǿ�ᣬ��YΪHNO3��
0.01mol/L��Z��ҺpH=8.5��˵��ZΪǿ�������Σ���ZΪNaNO2��
0.01mol/L��W��ҺpH=4.5��˵��WΪǿ�������Σ���WΪNH4NO3���ٽ�����ʵ��������������
��� �⣺X��Y��Z��W�ֱ���HNO3��NH4NO3��NaOH��NaNO2����ǿ������е�һ�֣�0.01mol/L��X��ҺpH=12��˵��XΪǿ���XΪNaOH��
0.01mol/L��Y��ҺpH=2��˵��YΪǿ�ᣬ��YΪHNO3��
0.01mol/L��Z��ҺpH=8.5��˵��ZΪǿ�������Σ���ZΪNaNO2��
0.01mol/L��W��ҺpH=4.5��˵��WΪǿ�������Σ���WΪNH4NO3��
��1��ͨ�����Ϸ���֪��XΪNaOH��WΪNH4NO3��
�ʴ�Ϊ��NaOH��NH4NO3��
��2��������Ϊ������ʣ���ˮ��Һ�ﲿ�ֵ���Ϊ����������Ӻ������ӣ����뷽��ʽΪ��HNO2?H++NO2-��
�ʴ�Ϊ��HNO2?H++NO2-��
��3��WΪNH4NO3��������ǿ���Σ�笠�������ˮ���ʹ����Һ�����ԣ�ˮ�����ӷ���ʽΪ��NH4++H2O?NH3•H2O+H+��
�ʴ�Ϊ��NH4++H2O?NH3•H2O+H+��
��4��X��Y��Z��1mol•L-1ͬʱ����ˮ���Ƶû����Һ����Һ�е�����Ϊ�����ʵ���Ũ�ȵ������ƺ��������ƣ�����������ˮ���ʹ��Һ�ʼ��ԣ���c��OH-����c��H+���������Ӻ���������Ӷ���ˮ�⣬������ˮ���������������Ũ�ȴ�С��ϵ��c��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
���� �����Ե���ʵĵ���Ϊ���忼��������Ũ�ȴ�С�ıȽϡ����ʼ�ķ�Ӧ������ˮ�⡢���ʵ��жϵ�֪ʶ�㣬��ȷ���ʵ������ǽⱾ��ؼ����ٽ���ε����������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| �� | �� | �� | ||||||
| �� | �� | �� | �� | �� | �� | �� | ||
| �� | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �ܶȣ�20�棩 | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
| A | 0.7137g/mL | -116.6 | 34.5 | ������ˮ |
| B | 0.7893g/mL | -117.3 | 78.5 | ��ˮ������Ȼ��� |
| A�� | ���� | B�� | ���� | ||
| C�� | ��ȡ | D�� | ��ˮ�������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ�����зǽ�������ǿ��Ԫ��λ�ڱ��������ұ� | |
| B�� | ԭ������Ϊ15��Ԫ�ص�����ϼ�Ϊ+3 | |
| C�� | ԭ������Ϊ38��Ԫ��λ��Ԫ�����ڱ��ĵ������ڣ��ڢ�A�� | |
| D�� | �ڶ����ڣ��ڢ�A��Ԫ�ص�ԭ�Ӻ˵������������һ��Ϊ6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6.4g ͭ��S��ȫ��Ӧ������ת��0.1 NA�� | |
| B�� | ��״���£�2.24 Lˮ�к���0.1 NA��ˮ���� | |
| C�� | 1.12 L�����к���0.1 NA����ԭ�� | |
| D�� | 0.1molNa2O2��������CO2��Ӧת�Ƶĵ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
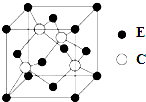 A��B��C��D��EΪԭ�������������������Ԫ�أ�A�ļ۵��Ӳ��е�δ�ɶԵ�����3����B������������Ϊ���ڲ��������3����C��DΪͬ����Ԫ�أ�CԪ�ػ�̬ԭ�ӵ�3p�������4�����ӣ�DԪ���������һ��δ�ɶԵ��ӣ�Eλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ2���ش��������⣺
A��B��C��D��EΪԭ�������������������Ԫ�أ�A�ļ۵��Ӳ��е�δ�ɶԵ�����3����B������������Ϊ���ڲ��������3����C��DΪͬ����Ԫ�أ�CԪ�ػ�̬ԭ�ӵ�3p�������4�����ӣ�DԪ���������һ��δ�ɶԵ��ӣ�Eλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ2���ش��������⣺ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
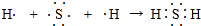 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Fe3+��=0.1mol•L -1����Һ�У�K+��NH4+��CO32-��SO42-�ܹ��� | |
| B�� | ��Al��Ӧ����H2����Һ�У�NO3-��Na+��SO42-��Fe2+һ�������� | |
| C�� | NaClO��Һ��ͨ������SO2��2ClO-+SO2+H2O�TSO32-+2HClO | |
| D�� | ��ͭ���缫���NaCl��Һ��2H2O+2Cl-$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
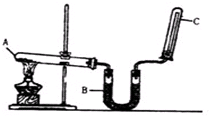 ʵ����ͨ������ͼ��ʾ��װ������ȡ����İ������ش��������⣺
ʵ����ͨ������ͼ��ʾ��װ������ȡ����İ������ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com