
| A. | PCl3→PCl5 | B. | HNO3→NO2 | C. | S→S2- | D. | SO3→H2SO4 |
分析 下列变化需要加入氧化剂才能实现,说明给予物质作作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中P元素化合价由+3价变为+5价,所以三氯化磷是还原剂需要氧化剂才能实现,如氯气,故A正确;
B.该反应中N元素化合价由+5价变为+4价,所以硝酸是氧化剂,需要还原剂才能实现,如铜等,故B错误;
C.该反应中S元素化合价由0价变为-2价,则S是氧化剂,需要还原剂才能实现,如氢气等,故C错误;
D.该反应中各元素化合价不变,不需要发生氧化还原反应才能实现,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重考查基本概念,明确化合价变化与氧化剂、还原剂关系是解本题关键,熟悉常见元素化合价.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
| 平均风速(m/s) 天气情况 | 空气中SO2的平均含量(mg/L) |
| 雨前 | 0.03 |
| 雨后 | 0.01 |
| 晴 | 0.015 |
| 晴 | 0.03 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质:CO2、Ca(OH)2、H2O、HNO3 | B. | 碱:NaOH、Ba(OH)2、Na2CO3、NH3•H2O | ||
| C. | 碱性氧化物:CaO、Na2O、FeO、Mn2O7 | D. | 盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
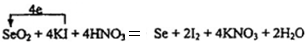 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com