
| A、c(CH3COOH) |
| B、c(H+) |
| C、c(OH-) |
| D、c(CH3COO-) |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度相等的HCl与HA,跟锌反应生成氢气的速率HCl比HA快 |
| B、pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多 |
| C、浓度相等的NaCl与NaA两溶液,前者是中性而后者为碱性 |
| D、浓度相等体积相同的HCl与HA两溶液与足量氢氧化钠溶液反应时,消耗的氢氧化钠一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验内容 | 结论 |
| A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| B | 向铁和稀硝酸反应后的溶液中滴加KSCN溶液,溶液显红色 | 反应后的溶液中肯定有Fe3+,可能还有Fe2+ |
| C | 常温下装有NO2的密闭容器置于热水浴中气体颜色加深 | 2NO2?N2O4△H<0 |
| D | 某气体能使湿润的淀粉碘化钾试纸变蓝 | 无法确定该气体一定是氯气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 验证NaHCO3和Na2CO3热稳定性大 |
B、 分离乙醇与水的混合物 |
C、 除去Cl2中的HCl |
D、 排水法收集氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液,其pH可能等于或大于7 |
| D、10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积(假设混合后的体积是两溶液体积之和)V(总)≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、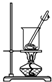 将海带灼烧成灰 |
B、 过滤得含I-的溶液 |
C、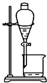 下层放出碘的苯溶液 |
D、 分离碘并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤⑥ | B、①⑤⑥ |
| C、①④⑤ | D、① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com