
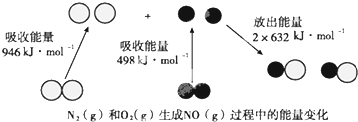
| A£® | N”ŌN¼üµÄ¼üÄÜĪŖ946kJ•mol-1 | |
| B£® | N2£Øg£©+O2£Øg£©ØT2NO£Øg£©”÷H=+180kJ•mol-1 | |
| C£® | µ±ÓŠ16gO2£Øg£©²Ī¼Ó·“Ó¦Ź±£¬øĆ·“Ó¦ĪüŹÕ90kJČČĮæ | |
| D£® | µ±ÓŠ1molµē×Ó·¢Éś×ŖŅĘŹ±£¬øĆ·“Ó¦ĪüŹÕ90kJČČĮæ |
·ÖĪö A”¢øł¾Ż²šæŖ1molij»Æѧ¼üĖłĪüŹÕµÄÄÜĮæ擳ÉøĆ»Æѧ¼üµÄ¼üÄÜ£¬½įŗĻĶ¼Ź¾¼“æɽā“š£»
B”¢øł¾Ż·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõČ„Éś³ÉĪļµÄ×ܼüÄܼĘĖć£»
C”¢øł¾ŻČČ»Æѧ·½³ĢŹ½ČČĮæÓėĪļÖŹµÄĮæ³ÉÕż±Č¼ĘĖć£»
D”¢øł¾ŻN2£Øg£©+O2£Øg£©ØT2NO£Øg£©”÷H=+180 kJ•mol-1£¬µ±ÓŠ1molµē×Ó·¢Éś×ŖŅĘŹ±£¬ĻūŗÄ0.25molŃõĘų£¬¾Ż“Ė¼ĘĖć£®
½ā“š ½ā£ŗA”¢ÓÉĶ¼æÉÖŖ£ŗN”ŌN¼üµÄ¼üÄÜĪŖ946kJ•mol-1£¬¹ŹAÕżČ·£»
B”¢·“Ó¦ČČĪŖ946kJ•mol-1+498kJ•mol-1-2”Į632kJ•mol-1=180 kJ•mol-1£¬ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2£Øg£©+O2£Øg£©ØT2NO£Øg£©”÷H=+180 kJ•mol-1£¬¹ŹBÕżČ·£»
C”¢øł¾ŻN2£Øg£©+O2£Øg£©ØT2NO£Øg£©”÷H=+180 kJ•mol-1£¬Ōņµ±ÓŠ16gO2£Øg£©²Ī¼Ó·“Ó¦Ź±£¬øĆ·“Ó¦ĪüŹÕ$\frac{16g}{32g/mol}$”Į180kJ•mol-1=90kJČČĮ棬¹ŹCÕżČ·£»
D”¢øł¾ŻN2£Øg£©+O2£Øg£©ØT2NO£Øg£©”÷H=+180 kJ•mol-1£¬µ±ÓŠ1molµē×Ó·¢Éś×ŖŅĘŹ±£¬ĻūŗÄ0.25molŃõĘų£¬ĖłŅŌøĆ·“Ó¦ĪüŹÕ0.25mol”Į180kJ•mol-1=45kJČČĮ棬¹ŹD“ķĪó£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é×ŪŗĻæ¼²é»Æѧ·“Ó¦ÓėÄÜĮæ±ä»ÆÖŖŹ¶£¬×¢Ņā¼üÄÜÓė·“Ó¦ČČŅŌ¼°·“Ó¦ĪļµÄĮæÓė·“Ó¦ČČµÄ¼ĘĖć¹ŲĻµ£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LŅŅ“¼ÖŠŗ¬ÓŠµÄŃõŌ×ÓŹżĪŖNA | |
| B£® | 64gµÄS2ŗĶS8»ģŗĻĪļÖŠ£¬ŗ¬ĮņŌ×Ó×ÜŹżĪŖ2 NA | |
| C£® | 1L 1mol/LĀČ»ÆĢśČÜŅŗÖŠ£¬ŗ¬ÓŠNAøöFe3+ | |
| D£® | 25”ꏱ£¬pH=13µÄBa£ØOH£©2ČÜŅŗÖŠŗ¬ÓŠOH-ŹżÄæĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ×å ÖÜĘŚ | IA | 0 | ||||||
| 1 | ¢Ł | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | |
| 2 | ¢Ś | ¢Ū | ¢Ü | |||||
| 3 | ¢Ż | ¢Ž | ¢ß | ¢ą | ||||
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļ”“×ĖįÓėĒāŃõ»ÆÄĘČÜŅŗµÄ·“Ó¦£ŗH++OH-=H2O | |
| B£® | ÄĘÓėĖ®·“Ó¦£ŗNa+H2O=Na++OH-+H2”ü | |
| C£® | ĀČĘųÓėĀČ»ÆŃĒĢśČÜŅŗµÄ·“Ó¦£ŗCl2+2Fe2+=2Cl-+2Fe3+ | |
| D£® | Ģ¼ĖįøĘČÜŅŗÓė×ćĮæĻ”ŃĪĖįµÄ·“Ó¦£ŗCO32-+2H+=H2O+CO2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ·ÓĄą-OH
·ÓĄą-OH ōČĖį-COOH--
ōČĖį-COOH-- Č©Ąą
Č©Ąą

 õ„Ąą
õ„Ąą
| A£® | £Ø1£©£Ø2£©£Ø3£©£Ø4£©£Ø5£© | B£® | £Ø2£©£Ø4£© | C£® | £Ø2£©£Ø3£©£Ø4£© | D£® | £Ø2£©£Ø4£©£Ø5£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com