
| m |
| n |
| 0.5L |
| 22.4L/mol |
| 1 |
| 44.8 |
| 0.9895g | ||
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
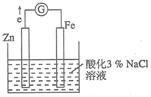 Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
⑴写出负极的电极反应式 。
⑵某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3: 。
⑶为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 。
⑷该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 。
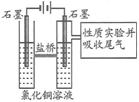 Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
⑴分析实验记录A中试纸颜色变化,用离子方程式解释:① ;
② 。
⑵分析实验记录B中浅蓝色固体可能是 (写化学式),试分析生成该物质的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com