
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.电子由Zn电极流出,经KOH溶液流向正极
B.正极反应式为2Fe +
+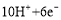 =Fe2O3+5H2O
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D. 电池工作时OH-向负极迁移
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次月考化学试卷(解析版) 题型:实验题

(1)D的名称是 ;
(2)提纯的步骤是:溶解、 过滤 、 ;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是 ;
(4)该实验中多次利用仪器B (填名称)和仪器 (填字母序号),且该仪器使用了 次 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
已知热化学方程式S(s)+O2(g)=SO2(g) ΔH=-297.23 kJ·mol-1,下列说法中正确的是( )
①S(g)+O2(g)=SO2(g) ΔH=-Q kJ·mol-1,Q值大于297.23 kJ·mol-1 ②S(g)+O2(g)=SO2(g) ΔH=-Q kJ·mol-1,Q值小于297.23 kJ·mol-1 ③1 mol SO2的键能总和大于1 mol S与1 mol O2的键能总和 ④1 mol SO2的键能总和小于1 mol S与1 mol O2的键能总和
A.①③ B.②④ C.①④  D.③④
D.③④
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:填空题
一定条件下,将一定体积的H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含a mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含有Cl-、ClO-、ClO3-且三者物质的量之比为8:1:1,则:
(1)原混合气体中Cl2的物质的量为 (用含a的数学式表示)。
(2)氢气和氯气的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA
B.足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA
C.密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA
D.3 g乙烷含有共用电子对为0.6 NA
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是

A.由X→Y反应的ΔH=E5?E2
B.由X→Z反应的ΔH>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈酸性的是
A.HCl B.NH4Cl C.CH3COONa D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是

A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用N2O4表示的平均化学反应速率是0.04 mol•L-1•min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:实验题
用已知浓度的HCl溶液测定未知浓度的氨水,选用的指示剂_____________
(2)取体积相同的、物质的量浓度相同的两分NaOH溶液,把其中的一份放空气中一段时间后。用已知浓度的硫酸中和上述这两份溶液,若中和第一份(放在空气中一段时间)所消耗硫酸溶液体积为V1,另一份消耗硫酸溶液体积为V2,
①若以甲基橙为指示剂时,V1和V2的关系是_ ___
②若以酚酞为指示剂时,V1和V2的关系是__ ____
(3)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用 0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 | NaOH终点读数 |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
①根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
②达到滴定终点的标志是_______________
③以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com