
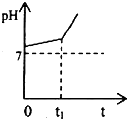
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:分析 (1)用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
(2)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH;
(3)根据Qc与Ksp的相对大小来确定有没有沉淀产生,溶解度越小越易形成沉淀;
(4)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k的公式计算;
(5)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水.
解答 解:(1)①由NH3.H2O?OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$减小,故错误;
②由NH3.H2O?OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以$\frac{c({H}^{+})}{c(O{H}^{-})}$增大,故正确;
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故错误;
④由NH3.H2O?OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,故正确;
故答案为:②④;
(2)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3•H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,则溶液中所有离子的物质的量浓度由大到小的顺序为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);
故答案为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);
(3)Qc=c(Ag+).c(Cl-)=0.001mol•L-l×0.001mol•L-l=10-6>Ksp(AgCl),所以有沉淀,KSP(AgCl)>KSP(AgI)沉淀转化,所以AgCl会转化为AgI,白色沉淀转化为黄色沉淀,离子反应为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:c(Ag+).c(Cl-)>Ksp(AgCl);AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
(4)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,混合后反应前c(NH3•H2O)=$\frac{a}{2}$mol/L,则反应后c(NH3•H2O)=($\frac{a}{2}$-$\frac{b}{2}$)mol/L,
则k=$\frac{c(N{H}_{4}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{b}{2}×1{0}^{-7}}{\frac{a}{2}-\frac{b}{2}}$=$\frac{b×1{0}^{-7}}{a-b}$,
故答案为:$\frac{b×1{0}^{-7}}{a-b}$;
(5)在0→t1时间内,相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑;用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,
故答案为:2Cl--2e-=Cl2↑;HCO3-+OH-=CO32-+H2O.
点评 本题考查较为综合,涉及电化学知识、弱电解质的电离以及沉淀溶解平衡,侧重于学生的分析能力和计算能力的考查,为高频考点,难度较大,注意相关计算公式的运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管外壁发热 | B. | 溶液最后变为蓝色 | ||
| C. | 溶液先变蓝最后褪色 | D. | 有气泡冒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L CaCl2溶液 | ||
| C. | 50mL 2 mol/L KCl溶液 | D. | 75 mL 1 mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入BaCl2溶液中无明显现象,说明碳酸的酸性比盐酸弱 | |
| B. | 氯水加入稀盐酸和AgNO3溶液产生白色沉淀,说明有氯水中有Cl-存在 | |
| C. | 常温下,Cu片投入到浓硫酸中不反应,因为浓硫酸使Cu产生钝化现象 | |
| D. | 浓硫酸具有脱水性,因而能使胆矾失去结晶水由蓝色变白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com