
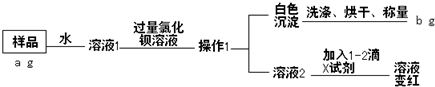
分析 NaOH药品部分变质会生成碳酸钠,将样品溶于水,加入过量的氯化钡,碳酸钠与氯化钡生成碳酸钡沉淀,过滤后得将固体洗涤、烘干、称量可得碳酸钡的质量,根据碳酸钡的质量可知样品中碳酸钠的质量,据此计算氢氧化钠的纯度,滤液中加入1-2滴酚酞,溶液呈红色,则溶液呈碱性,说明氢氧化钠没有完全变为碳酸钠,据此答题.
解答 解:NaOH药品部分变质会生成碳酸钠,将样品溶于水,加入过量的氯化钡,碳酸钠与氯化钡生成碳酸钡沉淀,过滤后得将固体洗涤、烘干、称量可得碳酸钡的质量,根据碳酸钡的质量可知样品中碳酸钠的质量,据此计算氢氧化钠的纯度,滤液中加入1-2滴酚酞,溶液呈红色,则溶液呈碱性,说明氢氧化钠没有完全变为碳酸钠,
①根据上面的分析可知,X试剂的名称为酚酞,操作1的名称为 过滤,
故答案为:酚酞; 过滤;
②证明氯化钡溶液已经过量,可以取上层清液少许于试管中,向其中加入少量(或几滴)氯化钡溶液,若未出现白色沉淀 (或溶液无明显变化),则证明氯化钡溶液已过量,
故答案为:取上层清液少许于试管中,向其中加入少量(或几滴)氯化钡溶液,未出现白色沉淀 (或溶液无明显变化),则证明氯化钡溶液已过量;
③根据碳元素守恒可知,样品中碳酸钠的质量为$\frac{106}{197}b$g,所以NaOH样品纯度为$\frac{a-\frac{106}{197}b}{a}$×100%=$\frac{197a-106b}{197a}$×100%,
故答案为:$\frac{197a-106b}{197a}$×100%.
点评 本题探究了氢氧化钠变质后成分的检验与测定,掌握物质的性质及检测原理是解题的关键,侧重考查学生计算和分析问题的基本能力,本题难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸氢钠在水中的电离方程式可表示为NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com