
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是![]()
![]()
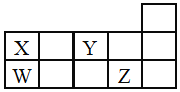
A.四种元素中原子半径最大为W,Y元素通常没有最高正价
B.酸性:![]()
C.![]() 、
、![]() 中所含化学键类型相同,熔点都很高
中所含化学键类型相同,熔点都很高
D.W、X形成的单质都是重要的半导体材料
【答案】A
【解析】
W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,X、Y位于第二周期,W、Z位于第三周期,Z位ⅦA族,则Z为Cl元素;Y位于ⅦA族,则Y为O元素;X、W位于ⅣA族,则X为C元素,W为Si元素,据此回答。
A. 同一主族从上到下原子半径逐渐增大,同一周期从左向右原子半径逐渐减小,则W的原子半径最大;Y为O元素,通常O元素没有最高正价,故A正确;
B. 非金属性![]() ,则最高价含氧酸的酸性:
,则最高价含氧酸的酸性:![]() ,故B错误;
,故B错误;
C. ![]() 为
为![]() ,
,![]() 为
为![]() ,二者所含化学键类型相同,都只含有共价键,但四氯化碳的熔点较低,故C错误;
,二者所含化学键类型相同,都只含有共价键,但四氯化碳的熔点较低,故C错误;
D. Si为半导体材料,但C不是半导体材料,如石墨为良导体,故D错误;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
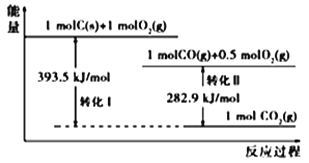
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
完成下列填空:
(1)上述反应中的还原剂为___,还原产物有___,当有1molKNO3参加反应时,转移电子的数目为___。
(2)KNO3晶体类型是___,其晶体中存在的化学键有___。
(3)硫原子的核外电子排布式为___,原子核外有___种不同能量的电子。将SO2和Cl2分别通入品红溶液中,产生的现象是___;若将SO2和Cl2等体积混合后再缓缓通入品红溶液,发现品红溶液___,其原因是___。
(4)S、C和N三种元素的原子半径从小到大的顺序是___;K2S溶液中除OH-外其它各离子物质的量浓度的大小顺序为___。
(5)下列事实能说明碳与硫两元素非金属性相对强弱的有___。
a.同温同浓度溶液pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
d.分解温度:CH4>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 代表阿伏加德罗常数的数值,下列说法正确的是
A. 2.4 g 金属镁变成镁离子时失去的电子数目为 0.1NA
B. 18 g 水中含有 0.1NA 个水分子
C. 22.4 L 氮气所含的电子数目为 NA
D. 17 g 氨气所含电子数目为 10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____kJ。
(2)理论上m1:m2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25 g·Lˉ1。有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:

(1)C中所含官能团名称是____。
(2)写出反应④的化学方程式____。
(3)C与D在一定条件下可发生加成反应,生成具有酸性的物质F。F的结构简式为___。
(4)下列说法正确的是____。(填编号)
A.有机物E与F互为同分异构体
B.用新制氢氧化铜悬浊液无法区分有机物B和C
C.有机物A、D均能被酸性高锰酸钾溶液氧化
D.可用饱和NaOH溶液除去有机物E中混有的少量B、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据如下:
化合物 | 密度/gcm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
I.乙酸正丁酯粗产品的制备
在干燥的A中,装入沸石,加入11.5mL正丁醇和9.4mL冰酷酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)。温度计及回流冷凝管,热冷凝回流反应。
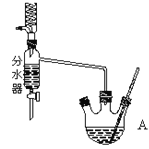
(1)实验过程中可能产生多种有机副产物。写出其中两种的结构简式:_________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:_________。
II.乙酸正丁酯粗产品的制备
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗,②蒸馏,③用无水MgSO4干燥,④用10%碳酸钠洗涤,正确的操作步骤是_________。
a ①②③④ b ③①④② c ①④①③② d ④①③②③
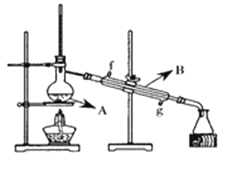
(4)将酯层采用下图所示装置蒸馏,图中仪器B的名称___________。冷却水从______口进入(填字母),蒸馏收集乙酸正丁酯产品时,应将温度控制在_________左右。
III.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M和乙炔可合成![]() 羟基丁酸,
羟基丁酸,![]() 羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。

已知:(1).
(2)![]()
(3)
(4)C的结构中不含有甲基
![]() A的结构简式为______,B的分子式______。
A的结构简式为______,B的分子式______。
![]() 反应
反应![]() 的反应类型______。
的反应类型______。
![]() 写出反应
写出反应![]() 化学方程式______。
化学方程式______。
![]() 某烃S是
某烃S是 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
![]() 理论上A也可以由1,
理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为______。
丁二烯与烃F来合成,则F的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com