
| A. | 40 | B. | 18 | C. | 12 | D. | 10 |
分析 分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,根据羧酸与醇组合,计算同分异构体数目即可.
解答 解:分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,属于饱和一元酯,若为甲酸和丁醇酯化,丁醇有4种;
若为乙酸和丙醇酯化,丙醇有2种;
若为丙酸和乙醇酯化,丙酸有1种;
若为丁酸和甲醇酯化,丁酸有2种;
故羧酸共有5种,醇共有8种,其中相同碳原子数的酸与醇分别为:甲酸与甲醇、乙酸与乙醇、丙酸与丙醇(有2种:正丙醇与异丙醇)、丁酸(有2种)与丁醇(丁醇有4种),故总共有:1+1+2+2×4=12种,
故选C.
点评 本题考查酯类的水解规律,同分异构体的书写与判断,难度较大,掌握丙基有2种、丁基有4种结构是解决本题的关键.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
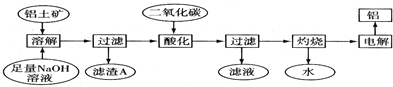
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
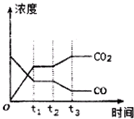 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
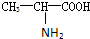 ),苯丙氨酸(
),苯丙氨酸(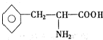 )
)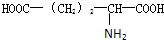 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )| A. | 10,4,3 | B. | 10,3,4 | C. | 9,4,3 | D. | 9,3,4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com