
【题目】下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A.Fe+2HCl=FeCl2+H2↑B.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.I2+2NaClO3=2NaIO3+Cl2↑D.2HCl+Ca(ClO)2=2HClO+CaCl2
科目:高中化学 来源: 题型:
【题目】为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
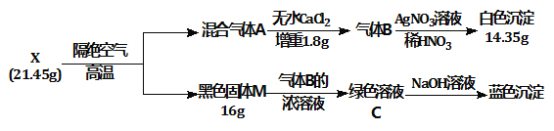
请回答:
(1) X的化学式是________。
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___________________________。
(3) 加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是
A.FeS2![]() SO3
SO3![]() H2SO4
H2SO4
B.NaCl(aq)![]() Na
Na![]() Na2O2
Na2O2
C.Fe![]() FeSO4(aq)
FeSO4(aq)![]() Fe(OH)2
Fe(OH)2![]() Fe2O3
Fe2O3
D.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() Fe
Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
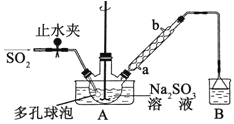
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
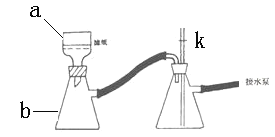
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式:_____________________________
(2)干燥管C内盛放的药品可以是______或________(填化学式)。干燥管的________(填“m”或“n”)端与g导管相连接。
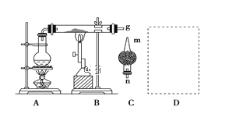
(3)在g处用试管收集氢气,简述用简单的方法检验收集到的气体是氢气的实验操作步骤和现象:_______________________________________
(4)停止反应后,待B处硬质玻璃管冷却后,取其中固体溶于过量的稀盐酸充分反应得溶液a,
①欲检验溶液中含有Fe3+,选用的试剂为溶液,现象是______________。
②该实验小组用上述试剂没有检测到Fe3+, 另取溶液a,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色,溶液中反应的离子方程式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的化学式为C5H11Cl,已知:分子中有两个—CH3、两个-CH2-、一个![]() 和一个-Cl,它的可能的结构有几种
和一个-Cl,它的可能的结构有几种
A. 2B. 3C. 4D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物B,俗名水杨酸,其结构简式为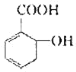 ,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com