
���� A��B��W��D��EΪ������Ԫ�أ���ԭ��������������A��W���γ�����Һ̬������A2W��A2W2����Һ̬������ֱ�ΪH2O��H2O2����AΪHԪ�أ�WΪOԪ�أ�A��Dͬ���壬��DΪNaԪ�أ�EԪ�ص���������������������ȣ���E��ԭ���������ӦΪ�������ڢ�A��Ԫ�أ���EΪAlԪ�أ�A��B��W��D��E��Ԫ��������֮��Ϊ39����B��ԭ������Ϊx������1+x+8+11+13=39��x=6������BΪCԪ�أ��ݴ˽��
��� �⣺A��B��W��D��EΪ������Ԫ�أ���ԭ��������������A��W���γ�����Һ̬������A2W��A2W2����Һ̬������ֱ�ΪH2O��H2O2����AΪHԪ�أ�WΪOԪ�أ�A��Dͬ���壬��DΪNaԪ�أ�EԪ�ص���������������������ȣ���E��ԭ���������ӦΪ�������ڢ�A��Ԫ�أ���EΪAlԪ�أ�A��B��W��D��E��Ԫ��������֮��Ϊ39����B��ԭ������Ϊx������1+x+8+11+13=39��x=6������BΪCԪ�أ�
��1��EΪAlԪ�أ�ԭ������Ϊ13��ԭ�Ӻ�����3�����Ӳ㣬��������Ϊ3��λ�����ڱ��������ڵڢ�A�壬
���������������Ʒ�Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪ��Al2O3+2OH-=2 AlO2-+H2O��
�ʴ�Ϊ���������ڵڢ�A�壻Al2O3+2OH-=2 AlO2-+H2O��
��2����H��C��O����Ԫ����ɵ�18��������������ֻ�ܺ���1��Cԭ�ӡ�1��Oԭ�ӣ��ʺ���Hԭ����Ŀ=18-6-8=4���ʸ����ṹ��ʽΪCH3OH��
�ʴ�Ϊ��CH3OH��
��3��A2W2ΪH2O2���Ƕ�Ԫ���ᣬ���ᴦ��BaO2���Ʊ�H2O2������BaSO4���ɣ���Ӧ�Ļ�ѧ����ʽΪBaO2+H2SO4=BaSO4��+H2O2��
�ʴ�Ϊ��BaO2+H2SO4=BaSO4��+H2O2��
��4������Fe2+�͵���KI��������Һ�е���H2O2���۲쵽��Һ����ɫ���к��ɫ�������ɣ���Ӧ����Fe��OH��3��I2��������2mol I-ʱ����ת��3mol���ӣ�˵����������Fe2+Ϊ1mol���μӷ�Ӧ��H2O2Ϊ1.5mol���÷�Ӧ�����ӷ���ʽ�ǣ�2Fe2++4I-+3H2O2=2Fe��OH��3��+2I2��
�ʴ�Ϊ��2Fe2++4I-+3H2O2=2Fe��OH��3��+2I2��
��5��NaH+H2O=NaOH+H2��
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2��
1mol 1mol 1.5mol
n��H2��=1mol+1.5mol=2.5mol��
V��H2��=2.5mol��22.4L/mol=56L��
�ʴ�Ϊ��56��
���� ���⿼��Ԫ�ص��ƶϺ�Ԫ�ػ�����֪ʶ���Ѷ��еȣ���������ڳ���������Ĵ���Ϊͻ�ƿڣ�ע����Ԫ�ػ�����Ŀ��飬����ʱע����������Ϣ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����賣�����ƹ��ά | |
| B�� | ���ô����ȥˮƿ�е�ˮ�� | |
| C�� | ��������Դ�������ɼ���PM2.5���ŷ� | |
| D�� | ��ҵ�ϳɰ������˹��̵� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg�Ľ����Ա�Alǿ | B�� | H-�����Ӱ뾶����Li+ | ||
| C�� | HCl�����ȶ��Ա�HFǿ | D�� | HClO4�����Ա�H3PO4ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
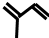 ����ش��������⣺
����ش��������⣺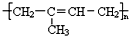 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100ml 18.4mol/L��������Һ�к������ӵ���ĿΪ3.68NA | |
| B�� | ��x g �к�NA�����ӣ���2x g�к�2NA������ | |
| C�� | ���³�ѹ�£�92gNO2��N2O4�Ļ�����庬�е�ԭ����Ϊ6NA | |
| D�� | 11g笠�����[NH2T2]+�к�������Ϊ4.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
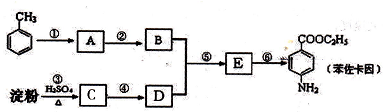
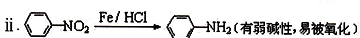
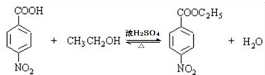 ��
��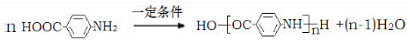
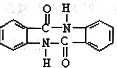 �нϺõ���ȼ�ԣ���д���Լױ�Ϊ��Ҫԭ���Ʊ�����ȼ���ĺϳ�·������ͼ��
�нϺõ���ȼ�ԣ���д���Լױ�Ϊ��Ҫԭ���Ʊ�����ȼ���ĺϳ�·������ͼ��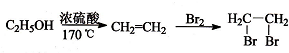
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | V=336 mLʱ��c��OH-��=c��H+��+c��HCO3-��+2c��H2CO3�� | |
| B�� | V=448 mLʱ��2c��Na+��=3[c��H2CO3��+c��HCO3-��+c��CO32-��] | |
| C�� | V=672 mLʱ��c��Na+����c��HCO3-����c��OH-����c��CO32-����c��H+�� | |
| D�� | ͨ��CO2�����к��й�ϵʽ��c��Na+��+c��H+��=c��OH-��+c��HCO3-��+2c��CO32-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com