
分析 依据阿伏伽德罗定律:相同条件下,气体体积相同,则气体物质的量相同,根据m=nM计算质量之比;
依据CO为双原子分子,CO2为三原子分子,计算原子个数比;
ρ=$\frac{M}{Vm}$计算两种气体密度之比.
解答 解:依据阿伏伽德罗定律:相同条件下,气体体积相同,则气体物质的量相同,所以二者物质的量之比:1:1;
依据m=nM,二者质量之比:1×28:1×44=7:11;
原子个数之比:1×2:1×3=2:3;
依据ρ=$\frac{M}{Vm}$可知密度之比与M成正比,所以相同条件下,体积相同的CO和CO2密度之比为:28:44=7:11;
故答案为:1:1,7:11,2:3,7:11.
点评 本题考查物质的量有关计算,熟悉以物质的量为核心计算公式,明确阿伏伽德罗定律是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
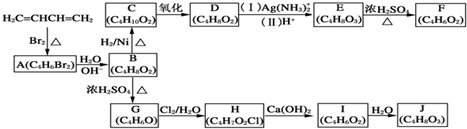
 +H2O,
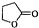
+H2O,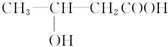 和
和 以外,还有
以外,还有 、
、 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构).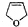 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com