
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
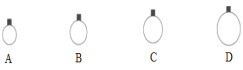
A. 气球B中装的是O2
B. 气球A和气球C中气体分子数相等
C. 气球A和气球D中气体物质的量之比为4∶1
D. 气球C和气球D中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变规律正确的是( )
A.Na、Mg、Al还原性依次增强
B.I2、Br2、Cl2氧化性依次减弱
C.C,N,O原子半径依次减小
D.P,S,F最高正价依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列问题:
(1) UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2) ![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知:![]() .
.
①NH4+ 的空间构型为__________________,与NH4+ 互为等电子体的分子或离子有________(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4) UO2 的晶胞结构及晶胞参数如下图所示:

①晶胞中U的配位数为_________________。
②UO2 的密度为_________________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com