
| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
分析 氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,中心原子化合价不变,溶于水一般生成酸的氧化物.
解答 解:A.CO2是酸性氧化物,能与碱反应:CO2+2NaOH=Na2CO3+H2O,故A正确;
B.CaO虽然是氧化物,但CaO与酸发生反应生成盐和水,属于碱性氧化物,不是酸性氧化物,故B错误;
C.水属于氧化物,既和酸不反应,又和碱不反应,不属于酸性氧化物,故C错误;
D.Na2O虽然是氧化物,但和酸发生反应生成盐和水,属于碱性氧化物,不是酸性氧化物,故D错误;
故选A.
点评 本题主要考查氧化物的概念,解答时要分析物质的元素组成,然后再根据氧化物概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
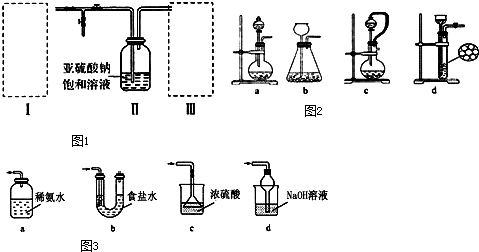
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
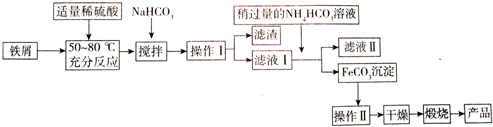
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com