
【题目】已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
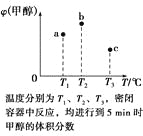
A. 正反应的ΔH>0
B. 反应进行到5 min时,b容器中v正=v逆
C. 减压可将b中的平衡状态转变成c中的平衡状态
D. 达到平衡时,a、b、c中CO的转化率为b>a>c
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2。下面对该反应的说法中正确的是( )
A.这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
B.这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
C.这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂
D.这是一个置换反应,有单质O2产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的原理分析,正确的是
A.失电子越多,该物质的还原性就越强
B.含有最高价元素的化合物一定具有强氧化性
C.氧化剂氧化其他物质时,本身被还原
D.某元素由化合态变成游离态一定被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g) + Y(g)![]() 2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A. 用X表示5min内此反应的反应速率是(0.1—0.2a)mol·(L·min)—1
B. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
C. 向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D. 向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐工业的叙述正确的是
A. 普通玻璃的主要成分可以表示为Na2O·CaO·6SiO2,说明玻璃为纯净物
B. 陶瓷、玻璃、水泥都属于硅酸盐产品
C. 制玻璃、水泥时都用到了石灰石和黏土
D. 制玻璃的过程中发生了反应:Na2CO3+SiO2![]() Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前已开发出用电解法制取ClO2的新工艺。
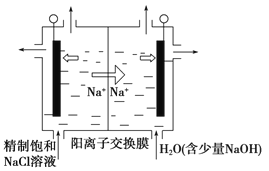
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com