
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
分析 A、将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中硝酸根离子与铵根离子的物质的量相等;
B、标况下三氧化硫为固体;
C、乙醇的水溶液中,水同样含有氢原子;
D、求出碳酸钠的物质的量n=CV,然后根据1mol碳酸钠中含2mol钠离子来分析.
解答 解:A、将3mol NH4NO3溶于一定浓度的稀氨水中,溶液呈中性,氢离子与氢氧根离子物质的量相等,根据电荷守恒可知,溶液中硝酸根离子与铵根离子的物质的量相等,由于硝酸根离子的物质的量为3mol,则铵根离子的物质的量为3mol,溶液中一定含有3NA个NH4+,故A正确;
B、二氧化硫和三氧化硫中均含1个S原子,故含有1mol硫原子的SO2与SO3的混合物为1mol,而在标况下三氧化硫为固体,故混合物的体积小于22.4L,故B正确;
C、10g质量分数为46%的乙醇水溶液中含有乙醇4.6g,含有0.1mol乙醇,0.1mol乙醇中含有0.6molH原子;溶液中水的质量为10g-4.6g=5.4g,水的物质的量为0.3mol,含有0.6mol氢原子,所以该乙醇的水溶液中含有1.2molH原子,含有的氢原子总数为1.2NA,故C正确;
D、溶液中碳酸钠的物质的量n=CV=1mol/L×1L=1mol,而1mol碳酸钠中含2mol钠离子,即为2NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
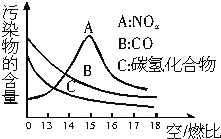 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
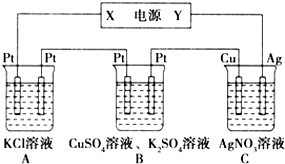 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里. | |
| B. | 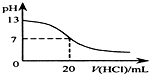 如图表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 | |
| D. | 常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com