
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L
科目:高中化学 来源: 题型:
某有机物分子结构简式为:
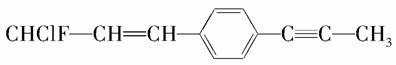 ,下列关于该有机物分子结构的说法中,正确的是( )
,下列关于该有机物分子结构的说法中,正确的是( )
A.除苯环外的其余碳原子有可能都在一条直线上
B.除苯环外的其余碳原子不可能都在一条直线上
C.12个碳原子不可能都在同一平面上
D.12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
结合已学知识,并根据下列一组物质的特点回答相关问题。
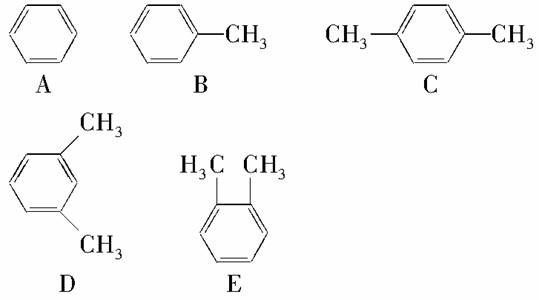
(1)邻二甲苯的结构简式为________(填编号,从A~E中选择)。
(2)A、B、C之间的关系为________(填序号)。
a.同位素 b.同系物
c.同分异构体 d.同素异形体
(3)请设计一个简单实验来检验A与D,简述实验操作过程:__________________________________________________________。
(4)有机物同分异构体的熔沸点高低规律是“结构越对称,熔沸点越低”,根据这条规律,判断C、D、E的熔沸点由高到低的顺序:______(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现通过以下步骤由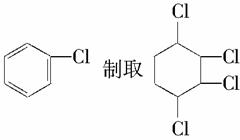 。已知
。已知 。
。
(1)从左到右依次填写每步所属的反应类型(a:取代反应;b:加成反应;c:消去反应,只填字母)______________。
(2)写出A―→B反应所需的试剂和条件:__________________。
(3)写出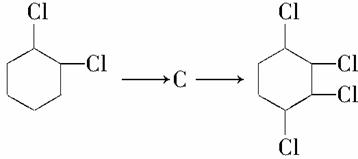 的化学反应方程式__________。
的化学反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为____________mL;所选用容量瓶的规格为____________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的蒸馏水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入蒸馏水至刻度线,定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是_____________________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至凹液面最低处与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度 线
线
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度变为0.01 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
铝制品比铁制品在空气中更不易被锈蚀的原因是( )
A、铝的金属活动性比铁弱
B、铝的密度比铁的密度小
C、铝在空气中易与氧气反应形成一层氧化物保护膜
D、铝不跟氧气发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝、铁三种金属单质中的两种组成的混合物共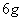 ,与足量的稀盐酸反应,产生标准状况下的氢气
,与足量的稀盐酸反应,产生标准状况下的氢气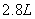 ,由此可判断混合物中必定含有( )
,由此可判断混合物中必定含有( )
A、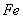
B、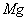
C、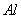
D、无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl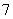 和AlCl
和AlCl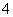 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com