
| A.称量12.8gCuSO4固体,在100mL烧杯中加入80mL蒸馏水充分溶解 |
| B.称量20gCuSO4?5H2O固体,用80mL容量瓶配制成溶液 |
| C.用容量瓶配制溶液过程中,玻璃棒起搅拌加速溶解和引流液体的作用 |
| D.当用胶头滴管定容时,若视线偏低,则所配制的溶液浓度偏低 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将25克CuSO4?5H2O溶于1升水中 |
| B.把16克CuSO4?5H2O溶于1升水中 |
| C.把25克CuSO4?5H2O溶于适量水中,室温时稀释至1升 |
| D.把25克CuSO4?5H2O加热除去全部结晶水,再配成1升溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1000mL,212g | B.950mL,201.4g |
| C.500mL,286g | D.任意规格,572g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.定容时仰视容量瓶刻度线 |
| B.定容时俯视容量瓶刻度线 |
| C.将溶解并冷却的溶液转移入容量瓶后就直接进行定容操作 |
| D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
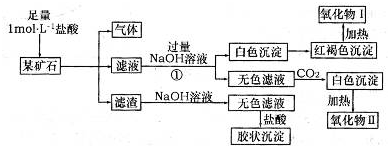
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
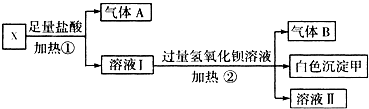
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com