
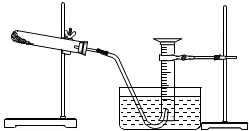
 某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:
某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:分析 (1)向CuSO4溶液中滴加NaOH溶液生成氢氧化铜沉淀和硫酸钠;
(2)在过滤操作时如果向过滤器中加入溶液速率太快,溶液的液面高过滤纸的边缘,会造成滤液浑浊,据此分析;
(3)①氯酸钾在氧化铜催化作用下加热分解生成氧气和氯化钾;
②根据制取氧气并用排水量气法测量产生氧氧的体积的方法可知,先给药品加热,待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内,停止加热,使试管冷却至室温,使量筒内液面与水槽中液面持平,然后读数,据此确定实验步骤;
③测得的气体体积比理论值低,可能是开始产生成的氧气未收集,或氯酸钾未完全分解等;
(4)初中化学中不加热不通电生成氧气的化学方法为在双氧水中加入二氧化锰作催化剂制氧气,或者用臭氧在催化剂的作用下生成氧气.
解答 解:(1)向CuSO4溶液中滴加NaOH溶液生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(2)在过滤操作时如果向过滤器中加入溶液速率太快,溶液的液面高过滤纸的边缘,会造成滤液浑浊,据此分析,
故答案为:溶液的液面高过滤纸的边缘;
(3)①氯酸钾在氧化铜催化作用下加热分解生成氧气和氯化钾,反应方程式为2KClO3$\frac{\underline{\;CuO\;}}{△}$ 2KCl+3O2↑,
故答案为:2KClO3$\frac{\underline{\;CuO\;}}{△}$ 2KCl+3O2↑;
②根据制取氧气并用排水量气法测量产生氧氧的体积的方法可知,先给药品加热,待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内,停止加热,使试管冷却至室温,使量筒内液面与水槽中液面持平,然后读数,所以实验步骤为abed,
故答案为:abed;
③测得的气体体积比理论值低,可能是开始产生成的氧气未收集,或氯酸钾未完全分解等,
故答案为:开始产生成的氧气未收集,或氯酸钾未完全分解等;
(4)初中化学中不加热不通电生成氧气的化学方法为在双氧水中加入二氧化锰作催化剂制氧气,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,或者用臭氧在催化剂的作用下生成氧气,反应方程式为2O3$\frac{\underline{\;催化剂\;}}{\;}$3O2,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,2O3$\frac{\underline{\;催化剂\;}}{\;}$3O2.
点评 本题主要考查氧化铜及性质实验等,难度中等,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,实验操作步骤的分析是易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
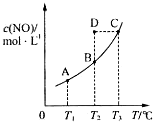 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
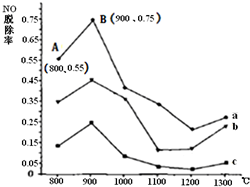 尿素[CO(NH2)2]在一定条件下能有效将NO转化为N2.如图为CO(NH2)2与某种烟气(主要为N2、NO)中NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率(NO的消耗量与NO的原始量的比值)随温度变化的曲线图.
尿素[CO(NH2)2]在一定条件下能有效将NO转化为N2.如图为CO(NH2)2与某种烟气(主要为N2、NO)中NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率(NO的消耗量与NO的原始量的比值)随温度变化的曲线图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44s | B. | 1s | C. | 7.33s | D. | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃是指分子里含有碳、氢元素的化合物 | |
| B. | 烃是指分子里含有碳元素的化合物 | |
| C. | 烃是指燃烧后能生成CO2和H2O的化合物 | |
| D. | 烃是指仅由碳和氢两种元素组成的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com