
 为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.| V |
| 10 |
| 1 |
| 2 |
100×
| ||
| M |
| 50(cV-10c′V′)×10 -3 |
| M |
| 50(cV-10c′V′)×10 -3 |
| M |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
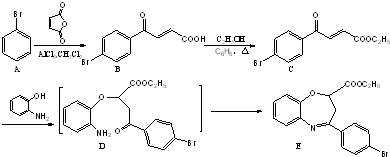
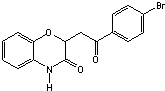 和一种常见的有机物F,F的结构简式为
和一种常见的有机物F,F的结构简式为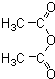
| H2O |
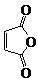 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐. 为原料制备化合物
为原料制备化合物 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| 浓H2SO4 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:| Cl2 |
| 光照 |
| NaOH/H2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

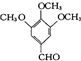
查看答案和解析>>
科目:高中化学 来源: 题型:
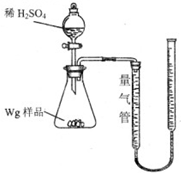 用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.
用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | ||
| ② | ||
| ③ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com