
| A. | NaCl、SO3的水溶液均能导电,所以NaCl、SO3均为电解质 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 用激光笔照射FeCl3溶液和Fe(OH)3胶体时,产生的现象不同 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
分析 A.水溶液中或熔融状态下导电的化合物为电解质;
B.金属单质在反应中只能失去电子,亚铁离子既有氧化性又有还原性;
C.胶体具有丁达尔效应;
D.合金硬度大于成分金属,合金熔点低于成分金属.
解答 解:A.SO3的水溶液能导电是因为三氧化硫溶于水和水反应生成硫酸是电解质电离出离子溶液导电,三氧化硫自身不能电离属于非电解质,故A错误;
B.金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故B错误;
C.胶体具有丁达尔效应、溶液没有丁达尔效应,所以可以用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液,故C正确;
D.合金的硬度比它的各成分金属大,合金熔点低于成分金属,故D错误;
故选C.
点评 本题考查了电解质概念、胶体的性质、氧化还原反应、合金的性质等,熟悉合金的硬度大,熔点低,耐腐蚀的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 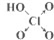 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有水参加的有机化学反应都可以叫做水解反应 | |
| B. | 丙烯、氯乙烯、苯分子内所有原子均在同一平面 | |
| C. | 棉花和木材在主要成分是纤维素,羊毛和蚕丝的主要成分是蛋白质 | |
| D. | 蔗糖是分布最广的二糖,一分子蔗糖能水解为两分子葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | |
| B. | 水分子的电子式: | |
| C. | 乙醇的结构简式:C2H6O | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸可用来刻蚀玻璃 | B. | 过氧化钠常用作供氧剂 | ||
| C. | 晶体硅可用于制作光导纤维 | D. | 漂白粉可用作游泳池的消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com