
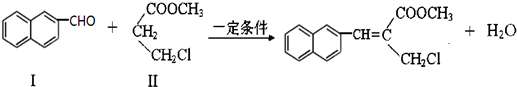
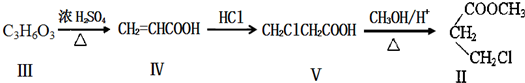
 )与1分子化合物(
)与1分子化合物(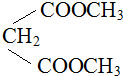 )也能发生Knoevenagel反应,则其生成的有机物的结构简式为
)也能发生Knoevenagel反应,则其生成的有机物的结构简式为| y |
| 4 |
| z |
| 2 |
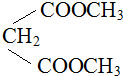 提供亚甲基2个氢原子,结合生成水,剩余基团连接得到有机物;
提供亚甲基2个氢原子,结合生成水,剩余基团连接得到有机物; 中羟基被氢氧化铜氧化为羧基,生成的羧基能与碱反应,同时生成氧化亚铜与水.
中羟基被氢氧化铜氧化为羧基,生成的羧基能与碱反应,同时生成氧化亚铜与水.| 醇 |
| △ |
| 醇 |
| △ |
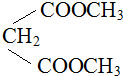 提供亚甲基2个氢原子,结合生成水,剩余基团连接得到有机物,则有机物的结构简式为:
提供亚甲基2个氢原子,结合生成水,剩余基团连接得到有机物,则有机物的结构简式为: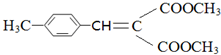 ,故答案为:
,故答案为: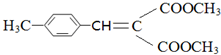 ;
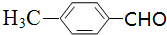
; 中醛基被氢氧化铜氧化,反应方程式为
中醛基被氢氧化铜氧化,反应方程式为 ,
, .
.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B、C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
| C、已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成1mol一氧化碳气体时△H=-(2.5x-0.5y)kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、290 | B、282 |
| C、280 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲烷与氯气反应制氯仿:CH4+3Cl2
| ||
B、烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2
| ||
C、甲烷、CO合成乙酸乙酯:2CH4+2CO
| ||
D、乙烯合成聚乙烯nCH4+2CO
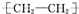 |
查看答案和解析>>
科目:高中化学 来源: 题型:
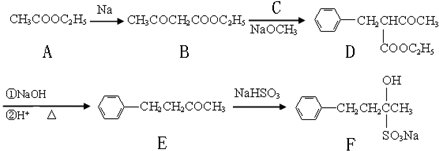
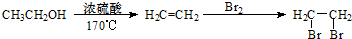
查看答案和解析>>
科目:高中化学 来源: 题型:
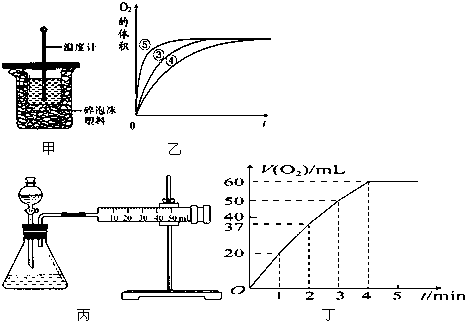 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、K+、SO42-、Cl-、AlO2- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com