
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3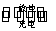 Na2S4+3NaBr
Na2S4+3NaBr
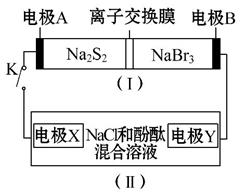
当闭合K时,X极附近溶液先变红色。下列说法中正确的是 ( )
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-====3NaBr
C.X电极的电极反应式为2Cl--2e-====Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就放出标准状况下的气体1.12 L
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
|
| A. | CO32﹣ | B. | Cl﹣ | C. | OH﹣ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的( )
|
| A. | MgO | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
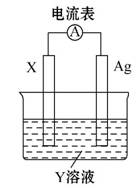
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-====Ag
D.外电路中的电子是从X电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于加成反应的是( )
|
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
|
| B. |
|
|
| C. |
|
|
| D. | CH3COOH+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H﹣) |
|
| B. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3) |
|
| C. | 将0.2mol.L﹣1的某一元酸HA溶液和0.1mol.L﹣1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA) |
|
| D. | 某溶液中水电离出的c(OH﹣)=1×10﹣amol.L﹣1若a>7时,则pH该溶液的一定为14﹣a |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 现将体积比为
现将体积比为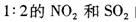 的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. 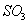 与
与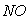 的体积保持不变 D.每消耗1mol
的体积保持不变 D.每消耗1mol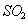 同时生成1mol
同时生成1mol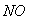
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com